端粒酶反义腺病毒载体对乳腺癌细胞MCF-7端粒酶的抑制作用
中华病理学杂志2000年第29卷第3期
张晓伟 童坦君
摘 要 目的 研究端粒酶RNA的反义对人乳腺癌细胞系MCF-7细胞端料酶活性的影响。方法 用重组腺病毒转移并表达端粒酶RNA的反义cDNA,采用基因重组、脂质体共转染法获得端粒酶反义重组病毒,用Southern杂交鉴定病毒的整合功能,用TRAP-银染法检测端粒酶活性。结果 MCF-7细胞是恶性乳腺癌的典型细胞系。与对照组MCF-7、MCF-7-vAd-AAV细胞相比,反义病毒感染后的MCF-7-vAdT-AAV细胞的端粒酶活性明显降低,只扩增出小片段的寡聚核苷酸。结论 端粒酶 rNA的反义cDNA的导入,可以显著抑制乳腺癌细胞的端粒酶活性。
关键词:乳腺肿瘤;端粒,末段转移酶;腺病毒,人;基因,抑制,肿瘤
端粒酶是由RNA和蛋白质组成的核蛋白,可以自身RNA为模板逆转录合成端区重复序列,使细胞获得永生化和恶性转化[1,2]。1994年,Kim等[3]发现90%以上的癌细胞都具有端粒酶活性,而生殖细胞与干细胞等正常细胞则无此酶活性。具有端粒酶活性的肿瘤细胞端区长度恒定,不随细胞分裂而缩短,恶性程度高,提示端粒酶在维持端区长度及肿瘤的恶性程度方面起着重要的作用。目前,人类端粒酶RNA(hTR)已经克隆成功[4],这使端粒酶的抗癌研究成为可能。由此,可应用反义RNA技术,通过抑制端粒酶RNA以抑制端粒酶活性,达到基因治疗的目的。我们将端粒酶RNA(hTR)的全长cDNA反向重组至整合型腺病毒载体pAdE1CMVITREXneo[5]上,感染端粒酶活性较高的人乳腺癌细胞系MCF-7细胞, 观察其对MCF-7细胞端粒酶活性的影响,以便今后进一步探讨端粒酶在肿瘤形成中的作用。
材料与方法
一、材料
1.细胞:293细胞为5型腺病毒(Ad5)E1基因转化的人胚肾细胞系,购自中科院上海细胞生物所。MCF-7细胞由本校病理学系郑杰惠赠。
2.质粒:pAdE1CMVITREXneo:整合型腺病毒载体,带有腺病毒左端0~16 mu(其中1.3~9.2 mu的E1区缺失),含AAV的2个ITR及neo基因表达盒(10.36 kb)由本室构建。pGRN83:含人类端粒酶RNA(hTR)的cDNA(3.588 kb),由美国Kevin kaster教授惠赠。pBHG11:去掉包装信号的Ad5基因组质粒(0.5~3.7 mu的E1区缺失和77.5~86.2 mu的E3区缺失,34.304 kb)。
3.菌种:HB101购自北京华美生物试剂公司。
4.主要试剂:细胞培养基为高糖DMEM(GIBCO BRL公司);胎牛血清购自北京北郊奶牛厂。Lipofectin为GIBCO bRL公司产品;限制性内切酶:MluⅠ、EcoRⅤ、EcoRⅠ、XbaⅠ、SalⅠ、HindⅢ等购自华美公司,Klenow 、CIP 、T4 ligase、Taq酶购自Promega公司。聚合酶链反应(PCR)引物由上海生物技术公司合成。上游(TS):5′-AATCCGTCGTCGAGCAGC-AGAGAGTT-3′,下游(CX):5′-CCCTTACCCTTACCCTTACCCTAA-3′。随机引物标记试剂盒购自Promega公司。其他试剂均为国产分析纯试剂。
二、方法
1.端粒酶RNA(hTR)的反义腺病毒载体的构建[6]参照图1。
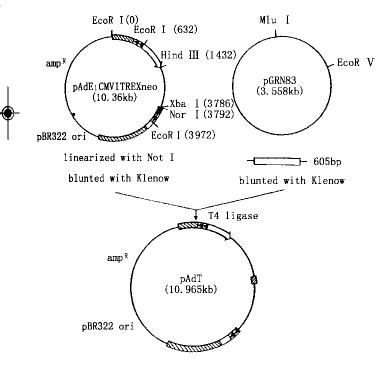
图1 hTR反义载体pAdT的构建示意图
2.反义重组腺病毒的获得:同源重组法收获重组病毒。在Lipofectin的介导下,穿梭质粒pAdE1CMVITREXneo、pAdT分别与pBHG11共转染293细胞,5 d后收集细胞,于-70℃冻融3次,直到出现典型的细胞病理变化。扩增病毒,提取病毒核酸,酶切鉴定病毒分别为空载体病毒vAd-AAV与反义重组病毒vAdT-AAV。测定病毒的滴度。
3.重组病毒整合功能的鉴定:重组病毒vAd-AAV与vAdT-AAV以100 mOI的感染量分别感染MCF-7细胞,提取MCF-7、MCF-7-vAd-AAV及MCF-7-vAdT-AAV3组细胞的基因组DNA,酶切转膜后,分别以neo、hTR cDNA为探针,用随机引物试剂盒(方法参照说明书),Southern杂交法[6]鉴定病毒的整合功能。
4.端粒酶活性测定[3]:采用TRAP-银染法,待测细胞长至80%~90%汇合时,用0.25%胰酶消化,PBS缓冲液洗2遍,4℃离心,沉淀重悬于1 ml预冷的洗涤液TRAP-1中。离心后弃上清,加40 μl冷裂解液TRAP-2,于0℃裂解30 min,13 500 r/ min,4℃离心30 min, 取上清液用Bradford法进行蛋白定量。端粒酶活性测定:反应体系含:20.0 mmol/L Tris-HCl,pH 8.3,1.5 mmol/L MgCl2, 63.0 mmol/L KCl, 0.005% tween-20, 1.0 mmol/L乙二醇二乙醚二氨四乙酸(EGTA), 50.0 μmol/L dNTP, 0.1 mg/ml牛血清蛋白( BSA), Taq酶5 U, TS(上游)引物0.1 μg,端粒酶6 μg,30℃,反应2 h。90℃灭活端粒酶活性。加CX(下游)引物0.1μg,混匀后覆盖石蜡油,进行PCR循环:94 ℃ 30 s,50℃ 30 s, 72℃90 s, 共30个循环。将25 μl PCR产物于12%非变性聚丙烯酰胺凝胶电泳,当溴酚蓝迁移至凝胶4/5距离时,停止电泳。将凝胶置于固定液(10.0%乙醇,0.5%乙酸)3 min,在固定液里加AgNO3至终浓度0.2%,染色5 min。弃固定液,蒸馏水漂洗2次:1次20 s,1次2 min。再加400 ml显色液(3% NaOH, 0.5%甲醛)轻轻晃动,直至显色。然后加固定液固定5 min,蒸馏水漂洗10 min。将胶置于干净玻璃板上照相。
结果
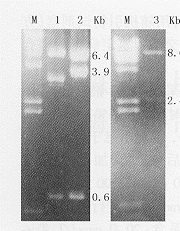
1.hTR的反义腺病毒载体pAdT的构建(图1):图2为hTR反义腺病毒载体pAdT的酶切鉴定电泳结果。提取质粒DNA并用EcoRⅠ酶切后,重组子可产生长度为0.6 kb、3.9 kb、6.4 kb的3条带,而空载体产生的条带为0.6 kb、3.3 kb、6.4 kb(见图2左),说明hTR cDNA已插入到pAdE1CMVITREXneo载体。将该重组子分别用HindⅢ、SalⅠ酶切后,0.8%琼脂糖凝胶电泳,产生长度为8.6 kb、2.4 kb的2条带(见图2右),说明hTR cDNA 反向插入到pAdE1CMVITREXneo中,从而获得hTR的反义腺病毒载体pAdT。
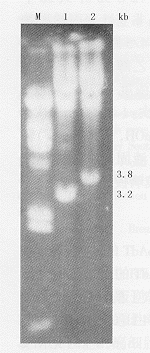
2.反义重组病毒的获得:重组病毒感染后293细胞出现典型的病理变化:细胞变圆、变大,有空泡形成,并见细胞脱落。提取病毒核酸,用限制性内切酶XbaⅠ酶切后,产生长度为3.2 kb和3.8 kb的2条DNA条带(图3),说明这2种病毒分别为vAd-AAV和vAdT-AAV。测得这2种病毒的滴度分别为7.8×108 pfu/ml与 6.2×108 pfu/ml。
M:λDNA/Hind
Ⅲ标记物;1:
vAd-AAV基因
组用Xba Ⅰ酶
切;2:vAdT-
AAV基因组用
XbaⅠ酶切
图3 重组病
毒核酸酶切鉴
定结果
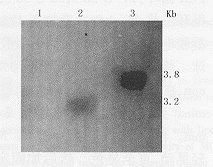
1:MCF-7;2:MCF-7-vAd-AAV;3:MCF-7-vAdT-AAV图4 以neo为探针鉴定病毒的整合功能的Southern杂交结果
1~3:用XbaⅠ酶切;4~6:用Hind Ⅲ+PstⅠ酶切;1,6:MCF-7;2,5:MCF-7-vAd-AAV;3,4:MCF-7-vAdT-AAV图5 以hTR cDNA为探针鉴定病毒整合功能的Southern杂交结果

M:λDNA/Hind Ⅲ标记物;1:pAdE1CMVITREXneo用EcoRⅠ酶切后;2:pAdT用EcoRⅠ酶切后;3:pAdT用HindⅢ+Sal Ⅰ酶切后图2 pAdT的酶切鉴定电泳结果
3.重组病毒整合功能的鉴定: MCF-7感染重组病毒后,分别以neo、hTR cDNA为探针,Southern blot鉴定病毒的整合功能。以neo基因为探针的Southern杂交结果见图4,MCF-7-vAd-AAV细胞和MCF-7-vAdT-AAV细胞分别在3.2 kb、3.8 kb处有杂交条带(XbaⅠ酶切),说明neo基因整合到细胞基因组上。为了进一步确定重组病毒的整合,又以hTRcDNA为探针进行Southern杂交分析(图5),除了内源性hTR基因片段
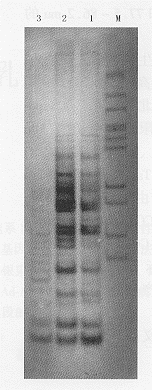
M:pGEM-7Zf(+)/HaeⅢ标记物;1:MCF-7;2:MCF-7-vAd-AAV;3:MCF-7-vAdT-AAV图6 端粒酶活性的TRAP-银染法检测结果
以外,MCF-7-vAdT-AAV细胞分别在3.8 kb处有杂交条带(以XbaⅠ酶切),在3.0 kb处有杂交条带(以HindⅢ、PstⅠ酶切),而对照组MCF-7细胞及MCF-7-vAd-AAV都没有特异的杂交条带。说明外源基因neo、hTR cDNA都已完整地整合到细胞基因组上。
4.端粒酶活性测定:如图6所示,MCF-7、MCF-7-vAd-AAV细胞扩增出多个相差6 bp的寡聚核苷酸,呈梯形排列,MCF-7-vAdT-AAV细胞只能扩增出小片段的寡聚核苷酸,说明hTR反义cDNA的导入,抑制了MCF-7细胞的端粒酶活性,使它逆转录合成(TTAGGG)n寡聚核苷酸的能力下降。
讨论
基因治疗最关键的问题是载体问题,高效病毒载体的开拓,将是基因治疗能付诸临床应用的重要保证。我们构建的整合型腺病毒载体pAdE1 cMVITREXneo是在腺病毒载体pAdE1CMV[7]的基础上,插入腺病毒相关病毒(AAV)的2个反转重复序列(ITRs)及新霉素抗性基因(neo)。因此,它集腺病毒和AAV病毒的优点,具有转导效率高、整合稳定、高效表达外源基因等功能。
1995年Singer等人分离并克隆了Hela细胞的端粒酶RNA,命名为hTR。我们[8]将hTR全长cDNA反向重组至整合型腺病毒载体pAdE1 cMVITREXneo,构建了hTR全长反义载体pAdT,与pBHG11共转染293细胞后获得的反义重组腺病毒vAdT-AAV,感染MCF-7细胞,能够将hTR cDNA整合至细胞基因组上,从而稳定持久地抑制端粒酶RNA,使细胞的端粒酶活性下降。并且细胞端区长度缩短,细胞的恶性度下降。
端粒酶是大多数肿瘤细胞持续分裂所必需的,因此,抑制端粒酶活性也许能够成为治疗肿瘤的新方法,它可能比目前所使用的化学疗法和基因疗法具有更大的优势。
基金项目:国家自然科学基金资助课题(39930170)和国家重点基础研究发展规划(G1999053906)资助课题作者单位:张晓伟(100083北京医科大学生化与分子生物学系)
童坦君(100083 北京医科大学生化与分子生物学系)
通信作者:童坦君(Email:biochem@mail.bjmu.edu.cn)
参考文献
1 Autexier C, Greider CW. Functional reconstitution of wild-type and mutant Tetrahymena telomerase. Genes Dev, 1994, 8: 563-575.
2 Mattei D, Scherf A. Subtelomeric chromosome instability in Plasmodium falciparum: short telomere-like sequence motifs found frequently at healed chromosome breakpoints. Mutat Res, 1994, 324:115-120.
3 Kim NW, Piatyszek MA, Prowse KR, et al. Specific association of human telomerase activity with immortal cells and cancer. Science, 1994,266:2011-2015.
4 Feng J, Funk WD, Wang SS, et al. The RNA component of human telomerase. science, 1995, 269:1236-1241.
5 王福山, 张晓伟, 童坦君.定点整合型基因治疗腺病毒载体的构建. 北京医科大学学报,1997,29:295-298.
6 萨姆布鲁克 J,弗里奇 GF,曼尼阿蒂斯 T,著.分子克隆实验指南.金冬雁,黎孟枫译.第二版,北京: 科学出版社,1989. 16-56.
7 张晓伟,王福山,童坦君. 绿色荧光蛋白cDNA在腺病毒重组载体转染中的应用.生物化学与生物物理进展, 1998, 25: 266-268.
8 张晓伟,廖海妮,童坦君. 端粒酶RNA的反义cDNA对乳腺癌细胞端区长度的影响.生物化学与生物物理学报, 1999, 31: 527-530.