深圳地区甲1(H1N1)亚型流感病毒基因特性的研究
中华实验和临床病毒学杂志 1999年第4期第13卷 论著
作者:程小雯 李良成 何建凡
单位:580020 深圳市,深圳市卫生防疫站
关键词: 流感病毒亚型;基因
【摘要】 目的 了解近几年H1N1亚型毒株在深圳地区人群中活动加强及“O”相特性出现的分子生物学基础及其基因演变的特性。方法 病毒粒RNA经逆转录合成cDNA,用PCR扩增,产物纯化,采用双脱氧链末端终止法进行核苷酸序列测定并推导出其所编码的氨基酸序列。进化树分析用DNA-STAR公司出品的序列分析软件,MegAlign(1.03版)的Editseq(3.69版)。结果 根据病毒粒HA1基因特性,至少1995年以来深圳地区人群中同时流行着基因特性不同的三系毒株;1995~1997年H1N1毒株与A/新加坡/6/86(H1N1)病毒相比较,其HA1蛋白分子上第54和155位上分别插入和缺失一个糖基化点,同时氨基酸序列发生了替换。结论 近年来深圳地区人群中同时流行着HA1基因不同的三系H1N1亚型毒株。由于HA1蛋白分子上氨基酸序列发生了替换,尤其糖基化位点插入和缺失,造成1995年以来H1N1毒株活动加强,这些可能与毒株“O”相特性再现密切相关。
Characterization of HA1 genes of influenza A (H1N1) viruses isolated in Shenzhen city
CHENG Xiaowen, LI Liangcheng, HE Jianfan.
Municipal Hygiene and Anti-epidemic Station of Shenzhen, Shenzhen 580020
【Abstract】 Objective To understand the molecular bases of intension of influenza virus activity and emergence of “O” phase of influenza A(H1N1) strains in human population in Shenzhen in recenty years ,and also the evolutionary characterization of influenza A(H1N1) HA1 gene.Methods Virion RNA was transcribed into cDNA by reverse transcriptase, cDNA was amplified by PCR, the products of PCR were purified. Afterward, RNA sequence analsis was performed by the dideoxynucleotide chain termination method using synthetic oligodeoxynucleotide primers. Finally, phylogenetic analysis of the sequencing data was performed with MegAlign(version 1.03) and Editseq (version 3.69) softwares.Results Since 1995, there were three different genetic lineages of influenza A(H1N1) virus HA1 gene cocirculating in men in Shenzhen city.Adding one and deleting one of potential glycosylation sites at 54 and 155 positions of amino acid sequences on HA1 protein domain of H1N1 viruses isolated recently was found as compared with those of A/Singapore/6/86(H1N1) virus. Meanwhile, there were some differences of amino acid sequences on HA1 protein molecules among H1N1 viruses tested and A/Singapore/6/86(H1N1) virus.Conclusion The intension of influenza A(H1N1) virus activity occurred since 1995 was due to emergence of substitution in amino acid sequences, especially the appearance of one addition and one deletion of potential glycosylation sites on their HA1 protein domains, and also was due to occurrence of influenza A(H1N1) virus with feature of “O” phase.
【Key words】 Influenza A(H1N1) virus Gene
甲1(H1N1)亚型流感病毒在人群中消失20年后,于1977年5月在我国北方突然重现,同年秋天蔓延至深圳地区。从此而后,深圳地区出现了人流感流行史上罕见的、同时流行着两个亚型(H3N2和H1N1)毒株的局面。1990年以来,H1N1与H3N2亚型和乙型流感病毒相比较,它在深圳地区一直处于劣势。然而,从1995年开始,它的活动有明显加强,同时重现了“O”相特性。故有必要了解H1N1亚型毒株近几年活动加强和“O”相特性出现的分子生物学基础,及其HA1基因演变的特点,为进一步搞好流感监测提供科学依据,也为深圳地区流感病毒基因库建立提供参考依据。
1 材料和方法
1.1 病毒(H1N1)亚型 A/深圳/227/95,A/深圳/30/96,A/深圳/223/97和A/深圳/240/97毒株,于1995~1997年流感监测中从流感患者中分离出,经鸡胚尿囊腔常规传代,收获的新鲜尿囊液用于RNA提取。A/新加坡/6/86(H1N1)病毒为1986~1996年国际性代表株。A/北京/262/95(H1N1)病毒为1998~1999年国际性代表株。它们的HA1基因核苷酸序列及其HA1区蛋白分子的氨基酸序列由国家流感中心提供。新加坡、北京和深圳分别用Sing, Bei和SZ代表。
1.2 病毒粒RNA提取 见文献[1]。
1.3 其他试剂 引物,35S-ATP,逆转录酶,PCR试剂盒,PCR产物纯化试剂盒以及Sequence System试剂盒均由国家流感中心提供。
1.4 cDNA合成和聚合酶链反应见文献[2]。
1.5 核苷酸序列测定 采用双脱氧链末端终止法[3]。基本步骤参考USB公司DNA Sequence试剂盒[1]。
1.6 进化树分析 用DNASTAR公司出品的序列分析软件,MegAlign(1.03版)和Editseq(3.69版)。
2 结果
由于流感病毒粒HA基因,尤其HA1基因具有高易变性并在决定流感疾病发生和流行中起着重要的作用,故随机从1995~1997年分离的H1N1亚型病毒中取4株(详见材料和方法中所列),测定其HA1基因的核苷酸序列并与两株代表性毒株进行分析和比较。根据HA1基因所编码HA1蛋白的核苷酸数量不同,所测定4株病毒可分为两大类:一类为SZ95-227和SZ97-240病毒与Sing86-6毒株一样含978个核苷酸,编码326个氨基酸;另一类为SZ96-30和SZ97-223病毒,它们与Bei95-262一样含975个核苷酸,仅编码325个氨基酸(少一个编码130位氨基酸的3个核苷酸);与参照株相比较未见有任何核苷酸插入。所有测定毒株,包括参照毒株,其重链(HA1)与轻链(HA2)连接处的核苷酸序列均为AGG编码一个精氨酸“R”。
根据所测出核苷酸序列推导出的氨基酸序列见图1。图1结果表明,所有毒株HA1蛋白N端前均有含17个氨基酸长的信号肽。SZ96-30和SZ97-233与Bei95-262毒株一样即HA1蛋白分子仅含325个氨基酸,于130位少一个赖氨酸“K”,而其它两株与Sing86-6一样含326个氨基酸。HA1蛋白分子上10个半胱氨酸“C”所有毒株间均相同,表明它们间双硫键均相同。然而,潜在糖基化位点和数目,不同毒株间有所不同。为便于比较,把不同毒株间潜在糖基化位点归纳于表1。
表1结果提示,不同毒株间潜在糖基化位点的数目不一样,分别含7~9个。但很有意思的是,1995年以后的毒株与1986年毒株相比较,它们在54~155位分别插入和缺失了一个潜在的糖基化位点。
从图1还可看出,不同毒株间HA1蛋白区氨基酸序列均存在有不同程度的差异。为便于分析和比较,将1995年以后毒株与1986年病毒发生氨基酸替换(不包括信号肽区)情况列于表2,1995年以后所出现的H1N1毒株与1986年参照毒株相比较有5个氨基酸位点发生了替换,同时5个均位于抗原决定簇上,并且后4个位于受体结合部位的周围。从图1可清楚看出,不同年代深圳毒株间,甚至同1997年毒株间HA1蛋白分子上氨基酸序列也存在差异,对它们进行进化树分析的结果见图2。
图2结果表明,按进化树可将4株深圳毒株分为3分枝:SZ97-233属于基因缺失的毒株系(见图2的上端);SZ97-240与广东97-105和Bei95-50属另一系(见图2的底部);而剩下两株,出乎意料地接近于A/USSR/90/77。这些结果清楚指出,当今深圳地区人群中同时流行着3种HA1基因明显不同的H1N1亚型毒株。
表1 H1N1亚型毒株HA1蛋白区潜在糖基化位点的比较
Tab.1 Comparison of position and number of potential glycosylation site on HA1 domain among influenza A(H1N1) viruses
| 病毒
Viruses |
潜在糖基化位点
Potential glycosylation site |
合计
Total |
| 10 |
11 |
23 |
54 |
87 |
125 |
155 |
160 |
205 |
269 |
297 |
| Sing 86-6 |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
- |
+ |
+ |
9 |
| Bei 95-262 |
+ |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
- |
+ |
9 |
| SZ95-227 |
+ |
+ |
+ |
+ |
+ |
- |
- |
+ |
- |
- |
+ |
7 |
| SZ96-30 |
+ |
+ |
+ |
+ |
+ |
+ |
- |
+ |
- |
- |
+ |
8 |
| SZ97-223 |
+ |
+ |
+ |
+ |
+ |
+ |
- |
+ |
- |
- |
+ |
8 |
| SZ97-240 |
+ |
+ |
+ |
+ |
+ |
- |
- |
+ |
- |
+ |
+ |
8 |

图1 H1N1亚型流感病毒HA1区蛋白分子上氨基酸序列比较
Fig.1 The deduced amino acid sequences of the HA gene HA1 region of the four H1N1 viruses compared with sequences of two H1N1 reference strains
“*”means deletion “-”means potential glycosylation site “…” potential glycosylation site deletion
表2 1995年以后H1N1毒株与1986年毒株相比较共同发生氨基酸替换的位点Tab.2 Comparison of altered amino acid residenes among the viruses isolated from 1995~1997 and the A/Singapore/6/86 virus
| 位点
Position |
病毒
Viruses |
抗原决定簇区
Antigenic determinant area |
| Sing86-6 |
Bei95-262 |
SZ95-227 |
SZ96-30 |
SZ97-223 |
SZ97-240 |
| 56 |
N |
S |
S |
S |
S |
S |
Ca1 |
| 57 |
I |
V |
V |
V |
V |
V |
Ca1 |
| 139 |
K |
N |
N |
N |
N |
N |
Ca2 |
| 141 |
R |
K |
K |
K |
K |
K |
Ca2 |
| 157 |
S |
L |
L |
L |
L |
L |
Sa2 |
| 178 |
V |
G |
G |
G |
G |
G |
Cal |
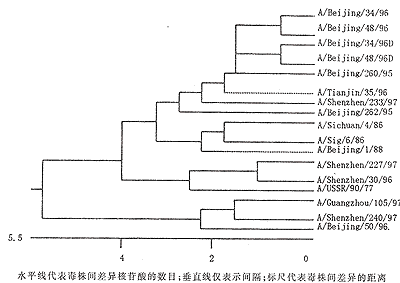
图2 甲1(H1N1)亚型流感病毒HA1基因序列进化树
Fig.2 Phylogenetic tree for the HA1 portion of the HA gene of influenza A(H1N1) viruses
The horizontal lengths of the branches are proportional to the nuclectide sequence differences; vertical lines are for spacing only. Scale is drawn to show the mutational distances between the viruses
3 讨论
自1977年以来,甲1(H1N1)亚型毒株一直存在于深圳人群中。1986年出现了A/京防/1/86(H1N1)新变异株,造成它的活动所加强外,它一直是我市人群中处于劣势的毒株,从1986年至1995年初,它的抗原性几乎未发生过明显的漂移。1957年之前,从人群中刚分离出的H1N1亚型毒株均表现出“O”相特性,而1977年重现的H1N1病毒均具有“D”相特性。奇怪的是,1995~1996年流感流行季节,H1N1亚型毒株不仅活动加强,而且重现了“O”相特性。其原因何在?本实验结果证明了这是由于1995年以来毒株与1986年毒株相比较,其HA1蛋白分子上重要部位(抗原决定簇并位于受体结合部位周围,见表2)氨基酸发生了替换,同时还发生了糖基化位点插入和缺失,加上出现了基因编码于缺失毒株所造成。
近来研究表明,流感病毒HA蛋白分子上糖基化位点和数目的改变,不仅能导致病毒株抗原性变异,而且能导致致病性和宿主范围的改变[4,5]。
基因发生学分析表明,近来深圳地区至少存在三类型HA1基因不同的毒株。SZ97-233和SZ97-240毒株看来是从外地,尤其是由北方传入的,而SZ96-30和SZ97-227从何而来?难下定论。不过,来自实验室污染可以排除,因为1977年深圳市卫生防疫站尚未成立,同时我站也从未保存过1977年的流感病毒株。
我们的研究不仅从分子生物学角度基本上弄清了1995年以来H1N1毒株活动增强和“O”相特性重现的原因,同时对弄清全国H1N1亚型毒株基因进化,彻底揭开“O”相毒株重现之迷及基因库的建立均具有重要的意义。
参考文献
1 郭无吉,董婕,王敏,等.甲3(H3N2)亚型流感病毒相变异分子生物学基础的研究.中华实验和临床病毒学杂志,1998,12:18-22.
2 Saiki RK, Gelfand DH, Stattels, et al. Primer-directed enzymatic amplication of DNA with a thermostable DNA polymerase. Science, 1988, 239:487-492.
3 Cox NJ, Kitame F, Klimov A, et al. Comparative studies of wild type and cold mutant(temperature-sensitive) influenza viruses: detection of mutation vaccine donor strain. Microbiol Pathogenesis, 1986, 1:387-392.
4 Kawaoka Y, Naeve CW, Webster RG. Is virulence of H5N2 influenza A viruses in chickens associated with loss of carbohydrate from the hemagglutinin? Virology, 1984, 139:303-316.
5 Ohuchi M, Ohuchi R, Feldmann A, et al. Regulation of receptor binding affinity of influenza virus hemagglutinin by its carbohydrate moiety. J Virol, 1997, 71: 8377-8384.
(收稿:1998-06-09 修回:1998-08-24)