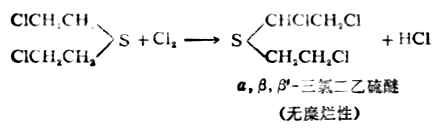第四节 硫酸和硫醚
硫在周期表内与氧同属第六主族,最外层未成对的p电子也是两个,因此硫也能形成与氧相类似的化合物。
R-OH 醇R-O-R ‘醚
R-SH硫醇R-S-R‘ 硫醚
一、硫醇的构造和性质
硫醇可看作是硫化氢(H2S)分子中一个氢被烃基取代的化合物,通式为R-SH。-SH称为巯基或氢硫基,它是硫醇的官能团。简单的硫醇有甲硫醇CH3SH、乙硫醇CH3CH2SH等。巯基也存在于某些结构复杂的化合物中,例如与人体代谢有关的辅酶A分子中就含有巯基。
低级的硫醇具有极难闻的臭味,沸点比对应的醇为低,微溶于水。高级的硫醇的臭味随相对分子质量的增大而逐渐减少,沸点则与相应的醇相近,难溶于水面易溶于有机溶剂中。
硫醇的化学性质与醇有相似的方面,也有不同的地方,如硫醇也可与酸成酯,但硫醇的酸性却比相应的醇强(例如乙硫醇的pKa为9.5,就比乙醇的pKa=17小得多)。因此硫醇可与氢氧化钠作用,也能与某些金属特别是重金属的氧化物作用,生成相应的硫醇盐。由重金属形成硫醇盐后大减低了重金属的毒性,因此临床上常用某些含有巯基的化合物作重金属中毒时的解毒剂。例如:
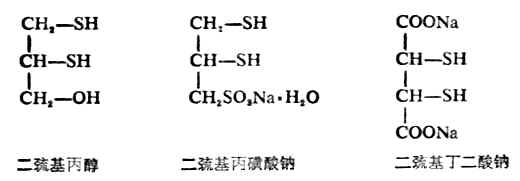
它们均含有两个相邻的巯基,能与砷、汞、锑等金属作用生成稳定无毒的环状化合物。例如:
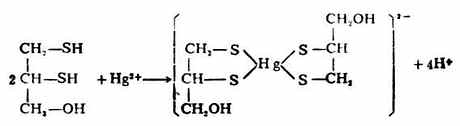 反应产物可由尿排出,从而使金属不再损害体内酶系统的活性,起到解毒作用。
反应产物可由尿排出,从而使金属不再损害体内酶系统的活性,起到解毒作用。
二巯式丙醇,最早是路易斯气(一种含砷的毒气CLCH=CHAsCL2)中毒的解毒剂,因毒性较大,已逐渐被其他解毒剂所代替,如二巯基丁二酸钠就是由我国创制的一个毒性较低、效力更强的新解毒剂。
硫醇另一个与醇不同的性质是,它容易被氧化生成二硫化物。
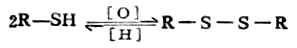
二硫化物
二硫化合物中的“-S-S-”键称二硫键,许多蛋白质的结构中存在这种键。当二硫化物还原时,二硫键断裂重新恢复原来的巯基。
二、硫醚的构造和性质
硫醚可看作是硫化氢分子中的两个氢原子都被烃基取代的化合物,通式为R-S-R。例如二甲硫醚CH3-S-CH3、甲乙硫醚CH3-S-C2H5等。
硫醚的物理性质与硫醇相似,但臭味不如硫醇那样强烈。硫醚易被氧化,而使硫的化合价从二价变为四价或六价,即硫醚第一步可氧化成亚砜,亚砜又可进一步氧化成砜。
芥子气(β,β‘-二氯二乙硫醚)是硫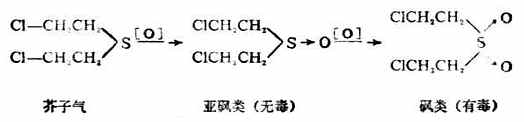
醚的衍生物,是持久性的糜烂性毒剂,对皮肤有腐蚀作用,沾在皮肤上引起难以痊愈的溃疡。它的蒸气能透过衣服,对人类的粘膜组织及呼吸器官都有损害作用。
芥子气是无色油状液体,沸点217℃,熔点14℃。具有芥末的气味,不溶于水,易溶于乙醇、苯等有机溶剂。
漂白粉能与芥子气起氧化、氯代反应,将芥子气变为毒性较小的亚砜等产物。