第一章 溶液
溶液是由两种或多种组分所组成的均匀体系。溶液对于科学研究、生命现象都具有重要意义。人的体液多是溶液,医疗用药亦多以溶液的形式或在体液内溶解后形成溶液而发挥其效应。可见溶液与医学的联系是极其密切的。所以,对于学习医学的人来说,了解有关溶液的物理和化学性质是非常必要的。
本章主要讨论有关溶液的概念、溶液的组成量度及渗透压。
第一节 溶解度
在一定条件(温度、压力)下,一定量的溶剂溶解溶质达饱和时,所含溶质的量称为溶解度。任何一种表示浓度的单位都可用来作为溶解度的单位。因此,根据工作需要,溶解度可以有各种不同的表示法,通常用一定温度下,100克溶剂形成饱和溶液时所溶解溶质的质量(单位为克)表示。
物质溶解度的大小与很多因素有关,主要决定于溶质和溶剂的本性以及外界的温度和压力。
一、 固体在液体中的溶解度
温度对固体物质溶解度的影响,可以通过实验绘成的溶解度曲线来表示。图1-1是几种固体盐类在水中的溶解度曲线。
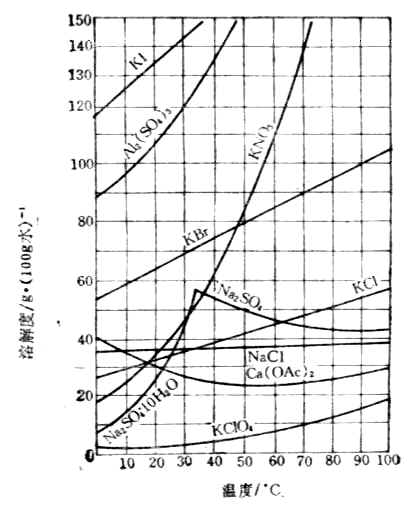
图1-1 溶解度曲线
从图1-1中可以看出,大多数固体物质的溶解度随温度升高而增大。个别物质如醋酸钙的溶解度,随温度的升高反而减小。还可看到硫酸钠的溶解度曲线,在32.4℃时出现了一个转折点。这是因为32.4℃左右时,硫酸钠的存在形式不同。在32.4℃以下,与饱和溶液呈平衡的固体是含结晶水的硫酸钠Na2SO4·10H2O,随温度升高溶解度增大。在32.4℃以上,与饱和溶液呈平衡的固体是无水硫酸钠Na2SO4,随温度上升而溶解度减小。
利用在不同温度下物质的溶解度不同这一性质,可以进行物质的提纯以除去其中杂质。在实际工作中,常将要是纯的物质先加热溶解于适当的溶剂中,使其成为饱和或接近饱和溶液,趁热滤去不溶性杂质,然后将溶液冷却,这时因物质的溶解度减小,势必从溶液中析出结晶,而可溶性杂质由于含量少,远未达到饱和而留在母液中。最后过滤,使析出的结晶与母液分离而得到较纯物质。这种操作称为重结晶。
值得注意的是有些物质在温度降低时,溶液中所含溶质的量虽超过了该温度下饱和溶液所含溶质的量,溶质也不析出,这种溶液称为过饱和溶液。过饱和溶液是不稳定的体系,稍一振荡或投入一小颗粒结晶,多余的溶质立即从溶液中析出而成为饱和溶液。
二、气体在液体中的溶解度
气体的溶解平衡是指在密闭容器中,溶解在液体中的气体分子与液体上面的气体分子保持平衡。溶解达平衡时,气体在液体中的浓度就是气体的溶解度。通常用1体积液体中所能溶解气体的体积表示。表1-1是一些气体在水中的溶解度。
表1-1 一些气体在水中的溶解度
| 温度/℃ |
O2 |
H2 |
N2 |
CO2 |
HCL |
NH3 |
| 0 |
0.0489 |
0.0215 |
0.0235 |
1.713 |
507 |
1176 |
| 20 |
0.0310 |
0.0182 |
0.0155 |
0.878 |
442 |
702 |
| 30 |
0.0261 |
0.0170 |
0.0134 |
0.665 |
413 |
586(28℃) |
| 35 |
0.0244 |
0.0167 |
0.0126 |
0.592 |
—— |
—— |
从表1-1中可以明显地看出,温度升高,气体的溶解度减小。也可以看出,不同的气体在水中的溶解度相差很大,这与气体及溶剂的本性有关。H2,O2,N2等气体在水中的溶解度较小,因为这些气体在溶解过程中不与水发生化学反应,称为物理溶解。而CO2,HCL,NH3等气体在水中的溶解度较大,因为这些气体在溶解过程中与水发生了化学反应,称为化学溶解。
气体在液体中的溶解,除与气体的本性、温度有关外,压力对气体的溶解度的影响也比较大。压力和分压的单位是帕(或帕斯卡,符号Pa),通常用千帕(符号kPa)表示。101.325kPa(或101325Pa)相当于过去1atm(1大气压),133.32Pa相当于1mmHg,作为非国际单位制的atm和mmHg本书不再使用。
(一)分压定律
混合气体的总压力等于各组分气体分压力之和。这一定律称为分压定律。这种关系可用数学式表示。
p=p1+p2+p3+…
式中,p是混合气体的总压力,p1,p2,p3等是各组分气体的分压力。
混合气体中每一种气体的分压力,可由总压力和该气体在混合气体中所占的体积百分数或摩尔分数的乘积来计算:
p1=p×(%V1)
或 p1=p×x1
式中,p为气体总压力,%V1为气体1的体积百分数,x1为气体1的摩尔分数。
例1 人的肺泡气总压力为101.325kPa,37℃时,它的组成用体积百分数表示分别为:O2为13.4%,CO2为5.3%,N2为75%,H2O(蒸汽)为6.3%,试求各气体在肺泡中的分压。
解:po2=101.325kPa×13.4%=13.6kPa
pCO2=101.325kPa×5.3%=5.4kPa
pN2=101.325kPa×75%=76.0kPa
pH2O=101.325kPa×6.3%=6.4kPa
(二)亨利定律
1803年亨利(Henry)从实验中总结出一条规律,其内容是:“在一定温度下,气体溶解达到平衡时,气体在液体中的溶解度和气相中该气体的分压成正比。”这一规律称为亨利定律。可用数学式表示:
c=Kp (1-1)
式中,c为气体在液体中溶解度,一般是指1kg水中溶解气体的质量(克);p为液面上气体的平衡分压;K为常数,是该气-液体系的特征常数。
必须注意,亨利定律只适用于压力不大(一般为202.3~303.9kPa)和溶解度很小的气体。温度越高或压力越低,在稀溶液中应用亨利定律能得到较准确的结果。另外,亨利定律只适用于不与溶剂发生化学反应的气体,即溶质在气相和液相中的分子状态必须是相同的。
例2 在0℃,平衡压力为303.9kPa。氧气的溶解度为0.2085g/1000g水。求在同温度、平衡压力为202.6kPa下氧气的溶解度。
解:由式(1-1)先求K值:
K=c/p=0.2085/303.9=0.000686(g/1000g水•kPa)
对于一定气体和溶剂,在一定温度下,K是一个常数,与气体的压力无关.在平衡压力为202.6kPa时,将K值代入式(1-1),则得在水中溶解度为:
c=Kp=0.000686×202.6=0.139(g/1000g水)
亨利定律在医学上有许多应用实例。例如,使用麻醉气体时,气体的分压越大,则它在血液中的溶解度就越大。高压氧气舱的压力为202.6-253.25kPa,比常压为大,因此溶于病人血液的氧气就越多.利用亨利定律还可以解释人在呼吸过程中O2和CO2的交换等。
(三)气体吸收系数
由于气体的体积比质量容易测定,所以气体的溶解度以溶解气体的体积表示比较方便。为了表示各种气体在不同温度和分压下的溶解度,规定将不同状态下所溶解气体的体积,均换算成标准状况下的体积数。
气体吸收系数(a)是指在一定温度下,1体积的液体在该气体分压为101.3kPa下,所能溶解气体的体积.气体体积如果不是标准状况(0℃,101.3kPa),一般要换算为标准状况.如在20℃和氢气分压为101.3kPa下,1L水能溶解氢气0.0195L.根据查理(Charles J.A.C.)定律可将其换算为标准状况下的体积:
0.0195L×273K/(273+20)K=0.0182(L)
0.0182即是在20℃时,101.3kPa下,氢气在水中的吸收系数。
与医学有关的气体在水和血浆中的吸收系数列于表1-2。
表1-2 37℃时气体在水和血浆中的吸收系数
| 气体 |
在水中的吸收系数 |
在血浆中的吸收系数 |
| O2 |
0.0239 |
0.0214 |
| CO2 |
0.567 |
0.515 |
| N2 |
0.0123 |
0.0118 |
从表1-2可以看出,当水中含有其他杂质时,气体的溶解度减少,尤其是有盐类存在时.由于盐类离子与水分子形成水合离子,这时影响则更大.血浆中含有盐类和蛋白质等,故气体在血浆中的溶解度比在水中要小.
利用表1-2的吸收系数,根据肺泡中O2,CO2,N2的分压,就能算出它们溶解在血浆中的体积百分数.
已知肺泡气体中Po2=13.6kPa,Pco2=5.3kPa.PN2=76.0kPa.因此,100mL血浆中所溶解的三种气体的体积百分数为:
O2%=0.0214×13.6/101.3×100=0.287(mL/100mL血浆)
CO2%=0.515×5.3/101.3×100=2.69(mL/100mL血浆)
N2%=0.0118×76/101.3×100=0.885(mL/100mL血浆)
三、液体在液体中的溶解度
一种液体在另一种液体中的溶解有三种情况:第一种是两种液体完全互溶,如乙醇与水、甘油与水等。第二种是两种液体部分互溶,如乙醚与水等。第三种是两种液体完全不溶,如苯与水、四氯化碳与水等。
将两种互不混溶的液体放在同一容器中,就会分成两相,密度大的一相的在下层,密度小的一相在上层。在一定温度下,一种溶质在相互接触的两种互不混溶的溶剂中,溶解达平衡时,溶质在两相中的浓度比是一个常数,这一定律称为分配定律。可表示如下式:
CA/CB=K (1-2)
式中CA、CB分别表示溶质在溶剂A、B中的浓度;常数K称为分配系数,它与溶质和溶剂的本性、温度及压力有关。
例如,将水和四氯化碳放在一起,加入少量碘,碘微溶于水、溶于四氯化碳。
在这两种液体中的溶解度差别很大。当温度一定时,水中碘的浓度与四氯化碳中碘的浓度比是一个常数。表1-3是碘在四氯化碳和水中分配情况。
| CB(I2在CCl4中)/mol.L-1 |
CA(I2在H2O中)/mol.L-1 |
CA/CB=K |
| 0.02 |
0.00023 |
0.0115 |
| 0.04 |
0.00046 |
0.0115 |
| 0.06 |
0.000702 |
0.0117 |
| 0.08 |
0.000928 |
0.0116 |
根据分配定律的原理,利用同一溶质在互不混溶的两种溶剂中溶解度的差别,可以选取适当溶剂,从另一溶液中将溶质提取出来。这个过程称为萃取。
萃取是一种有效的提纯、分离技术。为了充分使用一定量的萃取剂以提高萃取效率,采取每次少量,多次萃取的方法,要比一次用完萃取的效果好得多。反复多次萃取,萃取就可接近完全。