第四节 细胞和组织的损伤
细胞和组织损伤的表现形式和轻重程度不一,轻者当招致损伤的原因消除后仍可恢复,重者则可引起细胞和组织的死亡,兹分述如下:
一、变性和物质沉积
所谓变性(degeneration)乃指细胞或细胞间质的一系列形态改变并伴有结构和功能的变化(功能下降),表现为细胞间质内出现异常物质或正常物质而数量显著增多。但使用这一定义时必须慎重,因为有时细胞内某种物质的增多恰属生理现象而并非病理性改变。
一般而言,变性是可复性改变,当原因消除后,变性细胞的结构和功能仍可恢复。但严重的变性则往往不能恢复而发展为坏死。
变性可概括分为二大类;细胞含水量异常;细胞内物质的异常沉积。
(一)细胞水肿
人体约一半由水构成,其中约2/3存在于细胞内,约1/3存在于细胞外。在正常情况下细胞内外的水分互相交流,协调一致,保持着机体内环境的稳定。但当因缺氧、缺血、电离辐射以及冷、热、微生物毒素等的影响,而致细胞的能量供应不足、细胞膜上的钠泵受损,使细胞膜对电解质的主动运输功能发生障碍,或细胞膜直接受损时,则导致细胞内水分增多,形成细胞水肿,严重时称为细胞的水变性(hydropic degeneration)。
形态学:水肿的细胞体积增大,胞浆基质内水分含量增多,变得较为透明、淡染,胞核也常常被波及而增大、染色变淡、从而使整个细胞膨大如气球,故有气球变之称(图1-17)。电镜下,除可见胞浆基质疏松变淡外,尚可见线粒体肿胀及嵴变短、变少甚至消失;内质网则广泛解体、离断和发生空泡变。严重的水变性有时与渐进性坏死和坏死难以区分。
在电镜技术问世之前,有混浊肿胀之称,用以形容细胞肿胀和胞浆出现颗粒而变混浊,相应的器官(如心、肝、肾等实质性器官)在肉眼观上肿胀、边缘变钝、透明度降低(混浊)。电镜检查表明,胞浆内的颗粒实乃水肿时肿大的线粒体和扩张断裂的内质网,但有时也可为小泡状的蛋白质或其他物质的沉积。故为避免误解,现已放弃混浊肿胀这一名称。
结果:细胞水肿通常为细胞的轻度或中等度损伤的表现,当原因消除后仍可恢复正常。但如进一步继续发展,则可能形成脂肪变性甚或坏死。
(二)细胞内物质沉积
在病理状态下,不同的原因可以导致多种不同的物质在细胞和间质内异常沉积,为变性的主要表现。
1.脂肪沉积 正常情况下,除脂肪细胞外,其他细胞内一般不见或仅见少量脂滴。如这些细胞中出现脂滴或脂滴明显增多,则称为脂肪变性(fatty degeneration)。电镜下可见脂滴形成于内质网中,为有界膜包绕的圆形均质小体,称为脂质小体(liposome),其电子密度一般较高。初形成的脂滴很小,以后可逐渐融合为较大脂滴,从而可在光学显微镜下察见,此时常无界膜包绕而游离存在于胞浆中。
脂滴的主要成分为中性脂肪,但也可有磷脂及胆固醇等。在石蜡切片中,脂滴因被酒精、二甲苯等脂溶剂所溶解,故表现为空泡状,有时不易与水变性时的空泡相区别,此时可用苏丹Ⅲ或锇酸作脂肪染色来加以鉴别:苏丹Ⅲ将脂肪染成橘红色,锇酸将其染成黑色。
脂肪变性大多见于代谢旺盛耗氧多的器官,如肝、肾、心等,尤以肝最为常见,因为肝是脂肪代谢的重要场所。
(1)肝脂肪变性:肝细胞即能由血液吸收脂肪酸并将其酯化,又能由碳水化合物新合成脂肪酸。这种吸收的或新合成的脂肪酸仅少部分被肝细胞作为能源加以利用;大部分则以酯的形式与蛋白质相结合,形成前β脂蛋白,输入血液,然后或在脂库中贮存,或供其他组织利用;还有一小部分磷脂及其他类脂则与蛋白质、碳水化合物等结合,形成细胞的结构成分,即成为结构脂肪。因此,上述过程中的任何一个环节发生障碍便能导致肝细胞的脂肪变性;①脂蛋白合成障碍,以致不能将脂肪运输出去,造成脂肪在肝细胞内堆积。这常系由于合成脂蛋白的原料如磷脂或组成磷脂的胆碱等物质缺乏,或由于化学毒物(如酒精、四氯化碳)或其他毒素(如霉菌毒素)破坏内质网结构或抑制某些酶的活性,使脂蛋白及组成脂蛋白的磷脂、蛋白质等的合成发生障碍所致。②中性脂肪合成过多。这往往是由于饥饿或某些疾病(如消化道疾病)造成饥饿状态,或糖尿病患者对糖的利用障碍时,从脂库动员出大量脂肪,其中大部分以脂肪酸的形式进入肝,致肝合成脂肪增多,超过了肝将其氧化利用和合成脂蛋白输送出去的能力,于是导致脂肪在肝内的蓄积。③脂肪酸的氧化障碍,使细胞对脂肪的利用下降。例如白喉外毒素等能干扰脂肪酸的氧化过程,而缺氧即影响脂蛋白的合成,又影响脂肪酸的氧化。总之,肝细胞的脂肪变性乃上述某一因素或几种因素综合利用的结果。
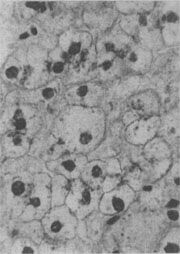
图1-17 肝细胞气球样变
>病毒性肝炎时,肝细胞明显肿胀,胞浆疏松呈气球样
形态学:轻度肝脂肪变性时,肝肉眼观可无明显改变,或仅轻微黄染。如脂仿变性比较显著和广泛,则肝增大,色变黄,触之质如泥块并有油腻感。镜下,肝细胞内的脂肪空泡较小,起初多见于核的周围,以后变大,较密集散布于整个胞浆中,严重时可融合为一个大空泡,将细胞核挤向胞膜下,状似脂肪细胞(图1-18)。脂肪变性在肝小叶中的分布与其病因有一定的关系,例如肝淤血时,小叶中央区缺氧较重,故脂肪变性首先在此处发生。但长期淤血后,小叶中央区的肝细胞大多萎缩、变性或消失,于是小叶周边区肝细胞也因缺氧而发生脂肪变性。磷中毒时,肝细胞脂肪变性则主要发生于小叶周边区,这可能是由于此区肝细胞对磷中毒更为敏感的缘故。
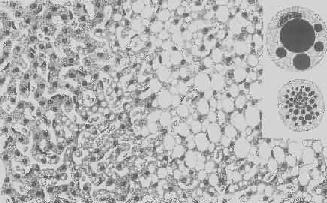
图1-18 肝细胞脂肪变性
肝细胞胞浆内出现大小不等的脂肪空泡;右上角为饿酸染色的脂肪细胞, 脂滴染成黑色
(2)心肌脂肪变性:心肌在正常情况下可含有少数脂滴,脂肪变性时脂滴明显增多。镜下,脂肪空泡较细小,呈串珠状成排排列,主要位于肌纤维Z带附近和线粒体分布区。常为贫血和中毒的结果。在严重贫血时,可见心膜下尤其是乳头肌处出现成排的黄色条纹,与正常心肌的暗红色相间排列,状若虎皮斑纹,故有“虎斑心”之称。严重感染、白喉外毒素以及其他毒物(如磷、砷、氯仿等)也能引起心肌的弥漫性脂肪变。肉眼观,心肌均匀变浊,略呈黄白色。但通常心功能并不受明显影响。显著的心肌脂肪变性如今并不常见。
(3)肾脂肪变性;在严重贫血、缺氧和中毒过程中,或肾小球毛细血管通透性升高时,肾小管特别是近曲小管的上皮细胞可吸收漏出的脂蛋白而导致脂肪变性。脂滴起初多位于细胞基底部。肉眼观,肾稍肿大,切面上可见皮质增厚,略呈浅黄色。
2.玻璃样变性 又称透明变性(hyaline degeneration),为十分常见的变性,主要见于结缔组织、血管壁,有时也可见于细胞内。
1.结缔组织玻璃样变:常见于纤维瘢痕组织、纤维化的肾小球,以及动脉粥样硬化的纤维性瘢块等。此时纤维细胞明显变少,胶原纤维增粗并互相融合成为梁状、带状或片状的半透明均质,失去纤维性结构(图1-19)。质地坚韧,缺乏弹性。玻璃样变的发生机制尚不甚清楚,有人认为在纤维瘢痕老化过程中,原胶原蛋白分子的交联增多,胶原原纤维也互相融合,其间并有较多的糖蛋白积聚,形成所谓玻璃样物质;也有人认为可能由于缺氧、炎症等原因,造成局部pH升高或温度升高,致使原胶原蛋白分子变性成明胶并互相融合所致。
2.血管壁玻璃样变:这种改变常见于高血压病时的肾、脑、脾及视网膜的细动脉。此时,可能是由于细动脉的持续性痉挛,使内膜通透性增高,血浆蛋白得以渗入内膜,在内皮细胞下凝固成无结构的均匀红染物质。此外,内膜下的基底膜样物质增多。这些改变使细动脉的管壁增厚、变硬,管腔变狭,甚至闭塞(图1-20),此即细动脉硬化症(arteri-olosclerosis),可引起肾及脑的缺血。
3.细胞内玻璃样变:亦称为细胞内玻璃样小滴变性。这种情况常见于肾小球肾炎或其他疾病而伴有明显蛋白尿时。此时肾近曲小管上皮细胞胞浆内可出现许多大小不等的圆形红染小滴(图1-21),这是血浆蛋白经肾小球滤出而又被肾小管上皮细胞吞饮的结果,并在胞浆内融合成玻璃样小滴,以后可被溶酶体所消化。此外,在酒精中毒时,肝细胞核周胞浆内亦可出现不甚规则的红染玻璃样物质。电镜下,这种物质由密集的细丝构成,据认为可能是细胞骨架中含角蛋白成分改变的结果,并被称为Mallory小体。
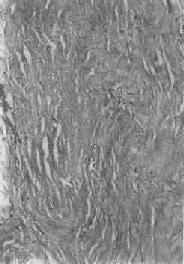
图1-19 纤维瘢痕组织的玻璃样变
>胶原纤维变粗,互相融合呈均质梁状×320
3.纤维素样变性(纤维蛋白样变性)为间质胶原纤维及小血管壁的一种变性。病变部位的组织结构逐渐消失,变为一堆境界不甚清晰的颗粒状、小条或小块状无结构物质,呈强嗜酸性红染,状似纤维素,并且有时呈纤维素染色,故称此改变为纤维素样变性(fibrinoid degeneration),其实为组织坏死的一种表现,因而也称为纤维素样坏死(fibrinoid necrosis)。
纤维素样变性主要见于急性风湿病及结节性动脉周围炎等变态反应性疾病。至于所谓纤维素样物质的性质和形成机制,至今尚无统一意见。一般认为,在早期,结缔组织基质中有PAS阳性的粘多糖增多,以后纤维崩解为碎片,从而失去原来的组织结构而变为纤维素样物质。此外,还有免疫球蛋白增多,有时还有纤维蛋白增多。这种改变可能是抗原抗体反应时形成的生物活性物质使间质受损、胶原纤维崩解所致。同时,附近小血管也可受损,引起通透性升高、血浆渗出,并在组织凝血系统的酶的催化作用下,使血浆纤维蛋白原转化为纤维蛋白。
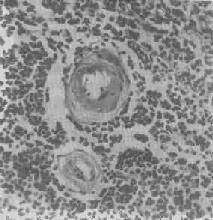
图1-20 脾中央动脉玻璃样变
>中央动脉管壁明显增厚,呈玻璃样均质状,管腔变窄 ×400
4.粘液性变性 组织间质内出现类粘液的积聚称为粘液样变性(mucoid degeneration)。镜下可见病变处的间质变疏松,充以染成淡蓝色的胶状液体,其中有一些多角形、星芒状细胞散在,并以突起互相联缀。
结缔组织粘液样变性常见于间叶性肿瘤、急性风湿病时的心血管壁、动脉粥样硬化的血管壁。甲状腺功能低下时,全身皮肤的真皮及皮下组织的基质中有较多类粘液(mucoid)及水分潴留,形成粘液水肿(myxedema),其机制可能是甲状腺功能低下时,能促进透明质酸酶活性的甲状腺素分泌减少,致透明质酸(类粘液的主要成分之一)降解减弱而大量潴积于组织内。
粘液样变性当病因消除后可以逐渐消退,但如长期存在,则可引起纤维组织增生,从而导致组织硬化。
5.淀粉样变性 组织内有淀粉样物质沉积称为淀粉样变性(amyloid degeneration,amyloidosis)。淀粉样物质为一种结合粘多糖的蛋白质,遇碘时被染成赤褐色,再加以硫酸则呈蓝色,与淀粉遇碘时的反应相似,故称之为淀粉样物质。此物质常浸润于细胞间或沉积于小血管的基底膜下,或沿网状纤维支架分布(图1-22)。淀粉样物质在HE染色切片中为淡红色均质状,电镜下则为纤细的丝状。
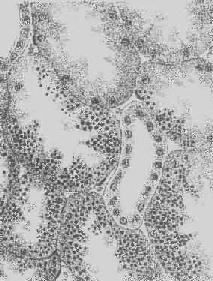
图1-21 肾近曲小管上皮细胞玻璃样小滴变
>上皮细胞胞浆内出现大小不等的均质圆形小滴

图1-22 肝淀粉样变
>淀粉样物质呈均质状,沉着于窦内皮下,肝细胞索受压萎缩×150
淀粉样变可为全身性和局部性二种。前者在我国极为罕见,多发生在长期慢性化脓、骨髓瘤及结核病等情况下。局部性淀粉样变则较常见,并好发于睑结膜及上呼吸道等处的慢性炎症而伴有大量浆细胞浸润时,发生机制不清。根据淀粉样物质中常有丙种球蛋白和血清中球蛋白增多的现象,有人认为这是由于抗原抗体反应在血中形成的蛋白复合物,也有人认为是浆细胞产生的免疫球蛋白与纤维母细胞、内皮细胞所产生的含硫粘多糖相结合而形成的复合物。
6.病理性色素沉积组织中可有各种色素沉积,其中有的来源于机体自身,称为内源性色素,如含铁血黄素、胆色素、脂褐素、黑色素等;有的则来自体外,为外源性色素,如炭末及纹身所用的色素。常见的病理性色素沉积有以下几种:
(1)含铁血黄素:含铁血黄素(hemosiderin)是由铁蛋白(ferritin)微粒集结而成的色素颗粒,呈金黄色或棕黄色而具有折光性。颗粒大小不一,是巨噬细胞吞食红细胞后在胞浆内形成的一种色素,为血红蛋白被巨噬细胞溶酶体分解而转化所成。由于铁蛋白分子中含有高铁(Fe3+),故遇铁氰化钾及盐酸后出现蓝色反应,称为普鲁士蓝或柏林蓝色反应。细胞破裂后,此色素亦可散布于组织间质中。左心衰竭时,在发生淤血的肺内可有红细胞漏出肺泡中,被巨噬细胞吞噬后形成含铁血黄素。这种细胞可出现于患者痰内,即所谓心衰细胞。当溶血性贫血时有大量红细胞被破坏,可出现全身性含铁血黄素沉积,主要见于肝、脾、淋巴结、骨髓等器官。
(2)胆红素(bilirubin):也是在吞噬细胞内形成的一种血红蛋白衍生物。在生理情况下,衰老的红细胞在单核吞噬细胞中被破坏,其血红蛋白被分解为珠蛋白、铁及胆绿素,后者还原后即成为胆红素,进入血液。血中胆红素过多时则将组织染成黄色,称为黄疸。胆红素一般呈溶解状态,但也可为黄褐色折光性小颗粒或团块。在胆道阻塞及某些肝疾患时,肝细胞、毛细胆管及小胆管内可见许多胆红素。黄疸明显时,胆红素颗粒亦可见于Kupffer细胞、肾小管上皮细胞内,并可在肾小管腔内形成胆汁管型。但人体因有血脑屏障的保护,胆红素通常不能进入脑和脊髓,而在新生儿则由于血脑屏障尚不完善,故在高胆红素血症(hyperbilirubinemia)时,大量胆红素可进入脑细胞内,使其氧化磷酸化过程受障,能量产生受抑,细胞乃发生变性,引起神经症状。肉眼观可见多处神经核(豆状核、下丘脑、海马回等)明显黄染,故称之为核黄疸。
(3)脂褐素(lipofuscin):为一种黄褐色细颗粒状色素,其成分约50%为脂质,其余为蛋白质及其他物质。脂褐素颗粒为细胞内自噬溶酶体(autophagolysosome)中的细胞器碎片发生某种理化改变后,不能被溶酶体酶所消化而形成的一种不溶性残存小体。正常人的附睾上皮细胞、睾丸间质细胞以及某些神经细胞的胞浆中可含有少量脂褐素。老年人及一些慢性消耗性疾病患者的肝细胞、肾上腺皮质网状带细胞的胞浆以及心肌细胞核两侧的胞浆中,均可出现脂褐素,故此色素又有消耗性色素之称。脂褐素颗粒在电镜下呈典型的残存小体(residual bodies)结构。
(4)黑色素(melanin):为大不、形状不一的棕褐色或深褐色颗粒色素。正常人皮肤、毛发、虹膜及脉胳膜等处均有黑色素存在。皮肤黑色素由黑色素细胞(melanocyte)产生:黑色素细胞中的酪氨酸在酪氨酶的作用下,氧化为二羟苯丙氨酸(dihydroxyphenylalanine,DOPA,多巴)。多巴被进一步氧化为吲哚醌,失去CO2后转变为二羟吲哚,后者聚后成一种不溶性的聚合物,即黑色素,再与蛋白质结合为黑色素蛋白。黑色素细胞内因含有酪氨酸酶,故当加上多巴时,则出现与黑色素相似的物质,谓之多巴反应阳性;相反,表皮下的噬黑色素细胞(melanophore),即吞噬了黑色素的组织细胞,因不含酪氨酸酶,故多巴反应阴性。用此方法可以鉴别黑色素细胞和噬黑色素细胞。人的垂体所分泌的ACTH能刺激黑色素细胞,促进其黑色素形成。当肾上腺功能低下时(例如Addison病时),全身皮肤黑色素增多,这是由于肾上腺皮质激素分泌减少,对垂体的反馈抑制作用减弱,致ACTH分泌增多,促进黑色素细胞产生过多的黑色素所致。局限性黑色素增多则见于黑色素痣及黑色素瘤等。
7.病理性钙化 正常机体内只有骨和牙含有固态的钙盐,如在骨和牙之外的其他部位组织内有固态的钙盐沉积,则称为病理性钙化。沉积的钙盐主要是磷酸钙,其次为碳酸钙。
在HE染色时,钙盐呈蓝色颗粒状,开始时颗粒微细,以后聚集成较大颗粒或片块,量多时肉眼可见为白色石灰样质块,难以完全吸收而成为机体内长期存在的异物,并刺激周围结缔组织增生而将其包裹。
病理性钙化主要有营养不良性钙化和转移性钙化两种。前者颇常见,乃变性坏死组织或异物的钙盐沉积,如结核坏死灶、脂肪坏死灶、动脉粥样硬化斑块内的变性坏死区,坏死的寄生虫虫体、虫卵以及其他异物等。此时,因无全身性钙磷代谢障碍,故血钙不升高。
营养不良性钙化的机制尚未阐明,可能与局部硷性磷酸酶升高有关:碱性磷酸酶能水解有机磷酸酶,使局部磷酸增多,超过3Ca2+×2PO43-的常值,于是形成磷酸钙沉淀。至于磷酸酶的来源,一部分显然是来自坏死细胞中的溶酶体,另一部分则可能系吸收自周围组织液中的磷酸酶。此外,钙化与局部组织的pH变动有关。变性坏死组织的酸性环境可使局部钙盐溶解,钙离子浓度升高,尔后由于组织液的缓冲作用,局部组织碱性化,故钙盐乃析出沉积。
转移性钙化较少见,是全身性钙、磷代谢障碍致血钙和(或)血磷升高,使钙盐在未受损的组织上沉积所致。如甲状旁腺功能亢进及骨肿瘤造成骨质严重破坏时,大量骨钙进入血液,使血钙升高,以致钙在肾小管、肺泡和胃粘膜等处沉积,形成转移性钙化。此外,接受超剂量的维生素D时,因促进钙从肠吸收,也可引起转移性钙化。
钙化对机体的影响视具体情况而异。转移性钙化可使钙化的组织、细胞丧失;血管壁钙化使血管失去弹性变脆,容易破裂出血。但结核病灶的钙化则有可能使其中的结核菌逐渐失去活力,减少复发的危险。然而结核菌在钙化灶中往往可以继续存活很长时间,一旦机体抵抗力下降,则仍有可能引起复发。
二、坏死
生活机体的局部组织、细胞死亡后出现的形态学改变称为坏死(necrosis)。坏死组织、细胞的代谢停止,功能丧失,出现一系列特征性的形态学改变。坏死的原因多种多样,举凡一切损伤因子,只要其作用达到一定的强度或持续一定的时间,从而使受损组织、细胞的代谢完全停止时,即引起组织、细胞的死亡(坏死)。在多数情况下,坏死是由组织、细胞的变性逐渐发展而来的,即渐进性坏死(necrobiosis)。在此期间,只要坏死尚未发生而病因被消除,则组织、细胞的损伤仍可能恢复(可复期)。但一旦组织、细胞的损伤严重,代谢紊乱,出现一系列坏死的形态学改变时,则损伤不再能恢复(不可复期)。
在个别情况下,由于致病因子极为强烈,坏死可迅速发生,有时甚至无明显的形态学改变。例如将生活中的组织、细胞立即投入甲醛溶液中固定时,细胞迅即死亡,但形态上则保持完好。故单纯从形态上有时难以判断细胞是否死亡。
由于损伤因子的性质不同,引起细胞死亡的途径也各异:X线引起DNA螺旋的断裂,导致细胞核信息中心的损害;CCl4通过过氧化物阻断核蛋白合成的翻译过程;缺血阻断线粒体的呼吸链;维生素A中毒使溶酶体酶外逸。因而,根据不同的损伤类型,某种细胞器的病变乃居于主要地位。
(一)坏死的病变
细胞坏死过程中的可复性改变与不可复性改变之间并无截然的界限,只有在损伤的后期,当出现明显的形态学改变时,才能在电子显微镜下判断细胞业已死亡。而在光学显微镜下,通常要在细胞死亡后若干小时之后,当自溶性改变相当明显时才能加以辨别。
1.细胞核的改变 细胞核的改变是细胞坏死的主要形态学标志,表现为:①核浓缩(pyknosis),即由于核脱水使染色质浓缩,染色变深,核的体积缩小;②核碎裂(karyorrhexis),核染色质崩解为小碎片,核膜破裂,染色质碎片分散在胞浆中;③核溶解(karyolysis),在脱氧核糖核酸酶的作用下,染色质的DNA分解,核乃失去对碱性染料的亲和力,因而染色质变淡,甚至只能见到核的轮廓。往后染色质中残余的蛋白质被溶蛋白酶所溶解,核便完全消失(图1-23)。这一状态约经10小时才能达到
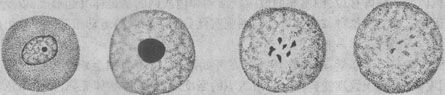
正常细胞 核浓缩 核碎裂 核溶解消失
图1-23 细胞坏死时核的变化模式图
坏死细胞核的上述变化过程可因损伤因子作用的强弱和发展过程的快慢而有所不同。损伤因子的作用较弱、病变经过缓慢时(如缺血栓梗死),上述核的改变可顺序发生,即先出现核浓缩,然后碎裂,最后核溶解;但如损伤因子作用强烈,经过急剧(如中毒),则往往先发生染色质边集,继即进入核碎裂,甚或可从正常核迅即发生核溶解。
2.细胞浆的改变 坏死细胞的胞浆红染(即嗜酸性),这是由于胞浆嗜硷性物质核蛋白体减少或丧失,使胞浆与硷性染料苏木素的结合减少而与酸性染料伊红的结合力增高的缘故。同时由于胞浆结构崩解,致胞浆呈颗粒状。有时由于实质细胞坏死后,整个细胞迅速溶解、吸收而消失(溶解性坏死)。有时单个实质细胞(如肝细胞)坏死后,胞浆内水分逐渐丧失,核浓缩而后消失,胞体固缩,胞浆呈强酸性染色(红染),形成所谓嗜酸性小体,称为嗜酸性坏死或固缩坏死。
3.间质的改变实质细胞坏死后一段时间内,间质常无改变。以后在各种溶解酶的作用下,基质崩解,胶原纤维肿胀并崩解断裂或液化。于是坏死的细胞和崩解的间质融合成一片模糊的颗粒状、无结构的红染物质。
上述坏死的形态学改变通常要在组织、细胞死亡后相当时间(数小时至10小时以上)才出现。在坏死的早期阶段,不仅肉眼观难以鉴别,甚至在电子显微镜下也不能确定该组织、细胞是否死亡。临床上将这种已失去生活能力的组织称为失活组织。这种组织已不能复活,但却是细菌生长繁殖的良好基地。为防止感染,促进愈合,在治疗中常需将其清除。
(二)坏死的类型
形态学上可将坏死分为以下类型:
1.局灶性胞浆坏死 并非任何致死性的细胞损伤均必然导致整个细胞的坏死。有时坏死仅局限于细胞的某一部位,称为局灶性胞浆坏死。这种坏死区由界膜加以包裹,从而与周围健康胞浆相隔离。这样,各种水解酶就可经内质网系统进入其中,将坏死结构加以溶解消化,而不致损伤细胞的其余部分。
2.凝固性坏死 坏死组织由于失水变干、蛋白质凝固而变成灰白或黄白色比较坚实的凝固体,故称凝固性坏死(coagulation necrosis)。特点是坏死组织的水分减少,而结构轮廓则依然较长时间地保存。
凝固性坏死的发生机制仍不甚清楚。Weigert认为是胞浆凝固的结果,因为溶酶体酶在此不起重要作用,这是由于或则组织所含溶酶体较少,或则溶酶体酶在某种程序上也受到了损伤的缘故。但在细胞僵死以前,在生体显微镜下可见到胞浆内的运动过程加强,表现为线粒体的一阵阵移位、细胞膜的波浪状活动和内质网的伪足样突起形成,以及细胞核的旋转运动。细胞的这种临终期运动与细胞有丝分裂开始时的运动相同。因此可以说细胞的死亡与新生的过程是相似的。
凝固性坏死的形态学:凝固性坏死灶在开始阶段,由于周围组织液的进入而明显肿胀,透明度降低,组织纹理变模糊。尔后组织的坚度逐渐增加,状如煮熟,呈土黄色。这些改变最早要在细胞死亡开始后6~8小时以后才能见到。坏死灶的周围形成一暗红色缘(出血边带)与健康组织分界。镜下,在较早期可见坏死组织的细胞结构消失,但组织结构的轮廓依然保存。例如肾的贫血性梗死初期,虽然细胞已呈坏死改变,但肾小球、肾小管以及血管等的轮廓仍可辨认。脾的贫血性梗死也是如此。
凝固性坏死的特殊类型:
(1)干酪样坏死(caseous necrosis, caseation):主要见于结核杆菌引起的坏死,如结核病灶的坏死。这时坏死组织彻底崩解,镜下不见组织轮廓,只见一些无定形的颗粒状物质(图1-24),同时由于坏死组织含有较多脂质(来自崩解的粒细胞和结核杆菌)故略带黄色,加之脂质又阻抑了溶酶体酶的溶蛋白作用,故结果形成了状如干酪的物质,因而得名。

图1-24 干酪性坏死(镜下)
>结核病灶中心的干酪样坏死,呈一片模糊细颗粒状无结构物质×150
(2)坏疽(gangrene):坏疽为组织坏死后又发生了继发性改变的结果。当大块组织坏死后,由于发生了不同程度的腐败菌感染和其他因素的影响而呈现黑色、污绿色等特殊形态改变,即成为坏疽。坏死组织经腐败菌分散,产生硫化氢,后者与血红蛋白中分解出来的铁相结合,乃形成黑色的硫化铁,使坏死组织呈黑色。坏疽可分为此下3种类型:
1)干性坏疽:干性坏疽是凝固性坏死加上坏死组织的水分蒸发变干的结果,大多见于四肢末端,例如动脉粥样硬化、血栓闭塞性脉管炎和冻伤等疾患时。此时动脉受阻而静脉仍通畅,故坏死组织的水分少,再加上在空气中蒸发,故病变部位干固皱缩,呈黑褐色,与周围健康组织之间有明显的分界线(图1-25)。同时,由于坏死组织比较干燥,故既可防止细菌的入侵,也可阻抑坏死组织的自溶分解。因而干性坏疽的腐败菌感染一般较轻。
2)湿性坏疽:湿性坏疽多发生于内脏(子宫、肺等),也可见于四肢(当其动脉闭塞而静脉回流又受阻,伴有淤血水肿时)。此时由于坏死组织含水分较多,适合腐败菌生长繁殖,故腐败菌感染严重,局部明显肿胀,呈深蓝、暗绿或污黑色。腐败菌分解蛋白质,产生吲哚(indole)、粪臭素(scatole)等,造成恶臭。由于病变发展较快,炎症比较弥漫,故坏死组织与健康组织的分界线不明显。同时组织坏死腐败所产生的毒性产物及细菌毒素被吸收后,可引起严重的全身中毒症状。常见的湿性坏疽有坏疽性阑尾炎、肠坏疽、肺坏疽及产后坏疽性子宫内膜炎等。
3)气性坏疽:为湿性坏死的一种特殊类型,主要见于严重的深达肌肉的开放性创伤合并产气荚膜杆菌、恶生水肿杆菌及腐败弧菌等厌气菌感染时,细菌分解坏死组织时产生大量气体,使坏死组织内含气泡呈蜂窝状,按之有捻发音。气性坏疽发展迅速,毒素吸收多,后果严重,需紧急处理。
3.液化性坏死 在液化性坏死(liquefaction necrosis)时,坏死组织起初肿胀,随即发生酶性溶解,形成软化灶。此时,坏死组织的水解占主导地位。与凝固性坏死相反,液化性坏死主要发生在含可凝固的蛋白质少和脂质多(如脑)或产生蛋白酶多(如胰腺)的组织。凝固性坏死的组织发生细菌感染时,则白细胞的水解酶也能引起组织溶解液化(如感染的肺梗死)。
液化性坏死时,坏死组织分解液化而呈液化,并可形成坏死腔。
脂肪坏死:脂肪坏死为液化性坏死的一种特殊类型,主要有酶解性脂肪坏死和外伤性脂肪坏死两种。前者常见于急性胰腺炎时,此时胰腺组织受损,胰酶外逸并被激活,从而引起胰腺自身消化和胰周围及腹腔器官的脂肪组织被胰脂酶所分解,其中的脂肪酸与组织中的钙结合形成钙皂,表现为不透明的灰白色的斑点或斑块。镜下,坏死的脂肪细胞仅留下模糊混浊的轮廓。外伤性脂肪坏死则大多见于乳房,此时由于脂肪组织受伤而致命伤脂肪细胞破裂,脂肪外逸,并常在乳房内形成肿块,镜下可见其中含有大量吞噬脂滴的巨噬细胞(泡沫细胞)和多核异物巨细胞。
4.固缩坏死 固缩坏大多为细胞的生理性死亡,乃细胞衰老过程中各个细胞功能逐渐息灭的结果。这种坏死通常仅表现为单个细胞坏死或小灶状坏死,而从不见整个实质区细胞同时坏死,故可与树叶的枯萎凋谢过程(apoptosis,凋落)相比拟。固缩坏死(凋落)的发生机制与上述凝固性或液化性坏死均不同,而是由细胞的遗传素质而决定的。根据遗传素质,各种细胞损伤性刺激可改变遗传信息的转录和(或)翻译,形成死亡蛋白,后者能激活核酸内切酶,引起核染色质的凝集,标志着固缩性坏死的开始,不可复性的胞浆损害继之发生。
固缩坏死即凋落见于许多生理和病理过程中,为各种更替性组织中细胞衰亡更新的表现,也可见于照射及应用细胞抑制剂之后和数目性萎缩时。肿瘤细胞也能自发地发生固缩坏死。
固缩坏死的最初形态表现为染色质沿皱缩的核膜下凝聚,细胞连接松解,微绒毛及细胞突起消失;细胞表面有一些泡状胞浆膨隆,可脱落形成凋落小体(图1-26),后者可见于腺腔内或被周围健康细胞所吞噬(例如肝细胞内的Councilman小体);继而内质网池扩大、断裂,线粒体结构虽仍完好,但基质呈絮状致密化。
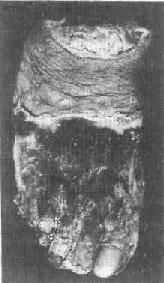
图1-25 足干性坏疽
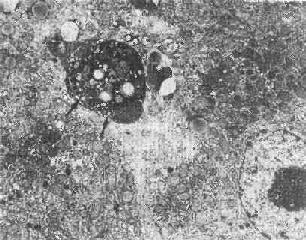
图1-26 肝细胞凋落小体(左上)
图中左上方电子致密团块(↑),其中可见脂滴及变性崩解细胞器。
>其右侧为一髓鞘样结构×4750
(三)坏死的结局
1.溶解吸收 这是机体处理坏死组织的基本方式。来自坏死组织本身和中性粒细胞的溶蛋白酶将坏死物质进一步分解、液化,然后由淋巴管或血管加以吸收,不能吸收的碎片则由巨噬细胞加以吞噬消化。留下的组织缺损则由细胞再生或肉芽组织形成予以修复或形成含有淡黄色液体的囊腔(如脑软化灶)。
2.分离排出 较大坏死灶不易完全吸收,其周围发生炎性反应,其中的白细胞释放溶蛋白酶,加速坏死边缘坏死组织的溶解吸收,使坏死灶与健康组织分离。坏死灶如位于皮肤的或粘膜,则坏死组织脱落后形成溃疡;肾、肺等内脏器官坏死组织液化后可经相应管道(输尿管、气管)排出,留下空腔,称为空洞。溃疡和空洞以后仍可修复。
3.机化(organization) 坏死组织如不能完全溶解吸收或分离排出,则由周围组织新生毛细血管和纤维母细胞等组成肉芽组织,长入坏死,逐渐加以溶解、吸收和取代,最后成为瘢痕组织。这种由新生肉芽组织取代坏死组织(或其他异物如血栓等)的过程称为机化。
4.包裹、钙化 坏死灶如较大,或坏死物质难以溶解吸收,或不能完全机化,则常由周围新生结缔组织加以包裹(encapsulation),其中的坏死物质有时可发生钙化(calcification),如结核病灶的干酪样坏死即常发生这种改变。