第二章 脂蛋白的组成与结构
正常人空腹血浆(血清)脂类浓度约为4g/L~8g/L。脂类一般均不溶于水,然而含有相当量脂类的血浆或血清却仍是清晰的。1929年Macheboeuf用半饱和(NH4)2SO4沉淀出马血清中的脂质和蛋白质复合物,首次提出血浆中脂质是和蛋白质相结合成血浆脂蛋白(lipoprotein,LP)这是一类大分子复合物,可使非水溶性脂类分散在血浆中,使血浆清晰而不混浊。
1924年,Svedberg和Rinde率先发明了以油锅轮驱动的超速离心机来研究金的胶颗粒。1935年Mcfarlane用分析超速离心的方法分析血清,从超速离心图上发现血清蛋白界面不对称,认为可能有多种蛋白质存在,含有脂质的组分可以在清蛋白附近沉降,这一组分被称为X蛋白。
1948年,Gofman等在美国加州大学的Donner实验室开始了他的超速离心上浮脂蛋白和其他理化性质的研究,利用Beckman公司的装有电驱动的新型超速离心机,观察超速离心中蛋白质分子的界面移动行为,认为“X蛋白”是可以上浮的组分,在超速离心过程中会产生一种倒置的峰,实验证实了他们的预测,从而开始了以上浮方法来分离脂蛋白,为脂蛋白的研究开辟了一个新纪元。
随后,1958年Gitlin,1956年Walton和1972年Alaupovic 等先后报道用密度梯度超速离心法将血浆脂蛋白分离为极低密度脂蛋白(very low density lipoprotein,VLDL)、低密度脂蛋白(low density lipoprotein,LDL)和高密度脂蛋白(high density lipoprotein,HDL)三大类;其脂蛋白微胶颗粒中的蛋白质部分称为载脂蛋白(apolipoprotein,apoprotein,Apo),并分为:ApoA、ApoB、ApoC和Apod,某些载脂蛋白还有其亚组分。

图2-1 脂蛋白结构图
第一节 脂蛋白的种类
脂蛋白是由脂质和蛋白质组成的复合物。在脂蛋白内的脂质与蛋白质之间没有共价键结合,多数是通过脂质的非极性部分与蛋白质组份之间以疏水键相互作用而结合在一起。因此脂蛋白的物理特性与其所含的脂质组成和蛋白性质密切相关,如图2-1所示。
一、密度梯度分类法
根据脂蛋白颗粒的大小及其密度分类,即根据在特定的盐密度内的漂浮行为,用超速离心技术可把血浆脂蛋白分成四大族:
乳糜微粒(chylomicron, CM):d<0.95g/ml
极低密度脂蛋白(VLDL):d=0.95~1.006g/ml
低密度脂蛋白(LDL):d=1.006~1.063g/ml
高密度脂蛋白(HDL):d=1.063~1.21g/ml
现在用密度梯度分级分离、亲和层析、电泳等技术与浮选技术联合应用于脂蛋白的分离,发现上述四种脂蛋白还可以分成若干亚族:
中间密度脂蛋白(IDL或LDL1):d=1.006~1.019g/ml
低密度脂蛋白(LDL2):d=1.019~1.063g/ml
高密度脂蛋白也是一种不均一的脂蛋白混合物,用物理方法至少可以再分成两个主要的亚族:
HDL2:d=1.063~1125g/ml
HDL3:d=1.125~1.210g/ml
另外还有极高密度脂蛋白(VHDL),密度范围为1.210~1.250g/ml。
表2-1 人血浆脂蛋白的种类及一般特性
| |
乳糜微粒 |
VLDL |
LDL1 |
LDL2 |
HDL1** |
HDL2 |
HDL3 |
VHDL |
| 漂浮速率 |
|
|
|
|
|
|
|
|
| Sf(1.063)* |
>400 |
20-400 |
12-20 |
0-12 |
0-2 |
- |
- |
- |
| Sf(1.210)* |
- |
- |
- |
- |
- |
3.6-9.0 |
0-3.5 |
- |
| 平均水合密度(g/ml) |
0.93 |
0.97 |
1.003 |
1.034 |
1.050 |
1.094 |
1.145 |
1.25 |
| 分子量 |
>0.4×106 |
5-10×106 |
3.9-4.8×106 |
2.2-3.0×106 |
- |
3.6×105 |
1.75×105 |
1.5×106 |
| 直径(nm,电镜) |
>70.0 |
25.0-70.0 |
22.0-24.0 |
19.6-22.7 |
- |
7.0-10.0 |
4.0-7.0 |
- |
| 电泳迁移率 |
|
|
|
|
|
|
|
|
| 滤纸、琼脂糖 |
原点 |
β |
- |
前β*** |
|
α |
α |
|
| 聚丙烯酰胺 |
原点 |
前β |
|
β |
|
α |
α |
|
| 蛋白质-脂质比例 |
1-2:98 |
10:90 |
18-20:80 |
20-22:78 |
35-40:60 |
40-45:55 |
55:45 |
65:35
|
*:sf=svedberg单位(×10-13cm/sec/dyne/gm)。括号内数字表示测定漂浮速率时的溶剂密度。
**:此类脂蛋白易变,直径为15nm,ApoE。
***Lp(a)也呈前β迁移率。
各类脂蛋白因密度及大小不同,含有不同种类和不同比例的脂质和载脂蛋白(见表2-1)。体积最大的脂蛋白为乳糜微粒,其内脂质占总量的98%,蛋白质仅占2%左右;体积最小的高密度脂蛋白颗粒内,脂质占总量的50%以下。乳糜微粒和极低密度脂蛋白代表运输甘油三酯的脂蛋白,都是从肝脏和肠把甘油三酯运送到其他组织,其代谢功能各不相同。乳糜微粒在小肠内形成,运输消化道内吸收的外源性甘油三酯(脂肪);而VLDL专职运输肝脏和肠粘膜细胞合成及分泌的内源性甘油三酯。另外两类脂蛋白,LDL和HDL是携带胆固醇的运输工具。愈来愈多的证据表明,HDL作为一个反向运载工具,从外周把胆固醇运送回肝脏进行代谢,在清除胆固醇的过程中有重要的作用。
二、电泳分类法
根据脂蛋白的电泳迁移率进行分类
血浆脂蛋白是人体脂质代谢紊乱的敏感指针,因此在临床实践中,脂蛋白分离分析已成为常规检验指标。少量血清标本可以用电泳方法快速分离出各类脂蛋白,常用的支持介质有醋酸纤维素薄膜、琼脂糖凝胶、聚丙烯酰胺凝胶。
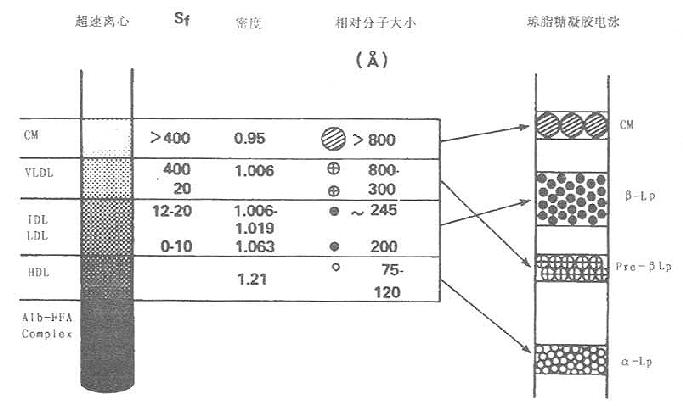
图2-2 超速离心法与电泳法分离血浆脂蛋白相应名称
醋酸纤维素薄膜电泳:特点是微量、快速、操作简便、吸附少、分离效果较好,能分离出α、前β、β及乳糜微粒等四条区带,有的血清有两条前β带。缺点是前β脂蛋白含量过高时会有拖尾现象,此外染色方法也不够理想,醋酸纤维素薄膜本身能被脂溶性染料着色,用苏丹黑B染色后背景深染,油红O虽然好一些,但脂蛋白带着色较浅。如用臭氧氧化后,碱性品红-亚硫酸试剂染色,所得图形清楚,背景着色较浅,缺点是染色步骤较繁,白蛋白部位有时染色过深。
琼脂糖电泳:琼脂糖是琼脂的主要成分,琼脂经处理惯除去其中的果胶后即为琼糖,由于琼脂糖中的硫酸根含量较琼脂少,电渗较弱,透明度高,对脂蛋白的分离效果比醋酸纤维素薄膜更好一些,可将血浆脂蛋白分成α、前β、β-脂蛋白和乳糜微粒。若用脂溶性染料染色,背景色浅,如将血清样品进行预染,可在电泳过程中直接观察分离效果,区带整齐,分辨率高高,重复性好。液相与固相无明显分界,电泳速度较快,干膜还可长期保存。缺点是需要临时制作凝胶板,不如醋酸纤维素薄膜方便。
聚丙烯酰胺凝胶电泳:兼有电泳和分子筛的双重作用,分辨率高,电泳时间短,分离的各脂蛋白带十分清晰。由于聚丙烯酰胺凝胶具有分子筛的作用,能阻碍颗粒较大的前β-脂蛋白分子移动,所以前β-脂蛋白的区带落在脂蛋白的后面。
脂蛋白经上述三种电泳分离后,可用分段洗脱染料比色(不适用于圆盘电泳),或用光密度计扫描定量。以血清球蛋白迁移率作为参照,HDL与α球蛋白迁移在同一位置故称α-脂蛋白;LDL与β球蛋白迁移在同一位置,称为β-脂蛋白;VLDL区带迁移在β脂蛋白之前故称前β-脂蛋白;乳糜微粒留在原点样处不动。电泳技术是临床检验血清蛋白模式的有效手段,因此这种命名法常应用于临床检验,如图2-2所示。
三、以载脂蛋白组成作脂蛋白颗粒分类
传统的脂蛋白分类是根据其密度和电泳行为分类,但是每一类脂蛋白不仅密度、大小、脂蛋白比是不均一的,载脂蛋白的组成也不同,载脂蛋白是唯一具有化学和免疫学独立特性的脂蛋白的组成部分,所以要进行准确的脂质运转研究,用传统的以物理性质分类的方法是有缺陷的。
Alaupovic提出将载脂蛋白组成作为鉴定脂蛋白颗粒的标志及脂蛋白分类的基础。每个脂蛋白颗粒只含一种载脂蛋白称为单脂蛋白,如LDL中多数脂蛋白只含ApoB100,称为脂蛋白B(LpB);若含有二种或二种以上不可分离的载脂蛋白叫复脂蛋白,如LDL中的脂蛋白颗粒含有ApoB、CI、CⅡ和CⅢ,称为LpB:CⅠ:CⅡ:CⅢ(LpB:C)。单脂蛋白和复脂蛋白是大颗粒脂蛋白体系中基本的化学实体,可以有不同的密度、大小、脂/蛋白比,但载脂蛋白的性质不变,具有特定的功能和代谢特征。
按Alaupovic提出的分类方法,ApoA和ApoB组成不同两类主要的脂蛋白颗粒,前者主要存在于HDL,而后者主要存在于VLDL和LDL中,每种都可分为单脂蛋白和复脂蛋白。含有ApoA的脂蛋白颗粒主要有LpAⅠ和LpAⅠ:AⅡ,含ApoB的脂蛋白颗粒有LpB,LpB:E,LpB:C,LpB:C:E和LpAⅡ:B:C:D:E等。
分离脂蛋白颗粒的方法主要是免疫亲和层析。
(1)含ApoA脂蛋白颗粒的分离:从ApoAⅡ抗血清提取免疫球蛋白(IgG),用抗ApoAⅡ-IgG与吸附剂交联制备免疫吸附柱,用pH7.0磷酸盐缓冲液平衡,将新鲜血清或HDL过柱,柱上保留的部分为LpAⅡ和LpAⅠ:AⅡ,滤出未保留的部分主要为Lpa Ⅰ,用3mol/L硫氰酸钠洗脱LpAⅡ和LpAⅠ:AⅡ,透析。分别将保留的部分洗脱的部分,通过抗ApoAⅠ-IgG交联的吸附柱,分离LpAⅠ、LpAⅠ:AⅡ、LpAⅡ和其他脂蛋白颗粒。用免疫扩散及免疫电泳方法鉴定LpAⅠ和LpAⅠ:AⅡ的载脂蛋白的组成。血浆中大约35~45%的ApoAⅠ存在于LpAⅠ,而55~60%存在于LpAⅠ:AⅡ,LpAⅠ占总的含ApoA脂蛋白的20~28%,LpAⅠ:AⅡ占72~80%,与LpAⅠ:AⅡ相比,LpAⅠ具有较高的胆固醇和较低的蛋白质组成,LpAⅠ和LpAⅠ:AⅡ的平均颗粒大小分别为379000和269000。
(2)含ApoB脂蛋白颗粒的分离:含ApoB脂蛋白颗粒可采用免疫亲和层析法,将VLDL和LDL中的脂蛋白颗粒分为富含胆固醇酯的LpB、LpB:E和富含甘油三酯(TG)的LpB:C,LpB:C:E和LpAⅡ:B:C:D:E等,其中LpB是主要的单脂蛋白,主要存在于LDL2中LpB:C和LpB:C:E是主要的复脂蛋白,随着密度的增加,胆固醇和胆固醇脂的含量升高而TG含量降低。
尽管对含ApoA和ApoB脂蛋白颗粒的功能和代谢研究还处在早期发展阶段,但已有许多证据表明,以载脂蛋白组成分类的脂蛋白颗粒具有功能一致性和代谢均一性,并有特定的致动脉粥样硬化(AS)作用或抗AS功效。
据报道,LpAⅠ和LpAⅠ:AⅡ具不同的功能和代谢特征。卵磷脂酯胆固醇酰基转移酶(LCAT)和胆固醇酯转运蛋白(CETP)主要存在于Lpa I而不存在LpAⅠ:AⅡ中。一项对有早发心肌梗塞家族史的青少年的研究表明,家族史与LpAⅠ有明显负相关,而与LpAⅠ:AⅡ无关,并认为,HDL抗动脉粥样硬化的功效在LpAⅠ,而不是LpAⅠ:AⅡ。含ApoB的脂蛋白颗粒,若ApoE/ApoC升高,则分解速度快。实验证明,ApoE含量升高,加快鼠灌注肝脏对富含TG脂蛋白的吸收,而ApoC则降低这一吸收;另外富含TG脂蛋白的降解速度不仅依赖于脂蛋白脂酶(LPL)的含量和活性,还与脂蛋白颗粒中LPL底物的反应性有关,如LpAⅡ:B:C:D:E的脂含量及脂蛋白质比与LpB:C和LpB:C:E很相似,而与LPL反应的速率常数比后两者低得多,水解速度慢,表明载脂蛋白组成对脂蛋白颗粒的分解代谢有重要影响。含ApoB脂蛋白颗粒也有不同的致AS作用,例如家族性高胆固醇血症(FH)病人的特点是LpB和LpB:E水平升高,LpAⅠ和LpAⅠ:AⅡ无明显变化;而高TG血症则伴随着LpB:C、LpB:c:E和LpAⅡ:B:C:D:E的升高及LpAⅠ和/或LpAⅠ:AⅡ的降低。富含TG的LpB脂蛋白颗粒也具有重要的致AS作用。如Ⅱa型病人LpB水平高。
四、其他脂蛋白的分类法
脂蛋白(a)[Lipoprotein(a),Lp(a)]由Berg在1963年制备LDL抗体过程中发现,当时测定Lp(a)在北欧人群分布率为30%,目前采用更灵敏的方法已发现其几乎存在于所有人群中,只是在血浆的浓度差异极大,从小于1mg/dl到大于100mg/dl。更重要的是Lp(a)在血浆中的水平与冠心病密切相关,其结构与纤维酶原极其相似。Lp(α)上浮密度在1.05~1.10g/ml,球型颗粒,直径为2.35~26.0nm,分子量4.6~5.6×106,Lp(α)在琼脂糖电泳中位于前β位置。Lp(a)含有ApoB100和Apo(a)两类载脂蛋白,前者与LDL的ApoB100相同,后者是Lp(a)的独特载脂蛋白。ApoB100与Apo(a)能通过1至2个二硫键共价相连,当用还原剂巯基乙醇或二硫苏糖醇处理Lp(a)时,Lpo(a)可从Lp(a)的分子上脱落下来,成为不含脂质的一类糖蛋白,剩下不含Apo(a)仅含ApoB100的颗粒称为Lp(a-)。
脂蛋白X:胆汁郁积时可特异地出现异常脂蛋白一脂蛋白X(lipoprotein,LpX)它是1969年由Seidel命名的。LpX上浮密度为1.035~1.063g/ml,直径40.0~60.0nm,厚度10.0nm,呈磷脂双层膜的圆盘状囊泡。LpX在正常成人为阴性,有报告6个月内机新生儿呈阳性者。LpX可作为诊断胆汁郁积的较灵敏的生物化学指标。