2 蛋白质
2.1 引言
蛋白质既是构造组织和细胞的基本材料,又与各种形式的生命活动紧密相联。在临床上,疾病的发生和预防、治疗和预后,也都和体内蛋白质的营养状况息息相关。
目前蛋白质的研究在化学结构、空间构象、生物功能及其调节控制等方面都有很大发展,只有在蛋白质的生化基础上理解蛋白质的营养意义,才能更好地在临床上应用。
2.2 蛋白质的生化
2.2.1 蛋白质的化学
蛋白质分子是生物大分子,分子量约从5,000到数百万。其基本单位是氨基酸,通式为:
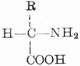
由于氨基和羧基都在α-C上,故称为α-氨基酸。式中R表示侧链。侧链不同,氨基酸的种类就不同。组成蛋白质的氨基酸一共有20种,各氨基酸按一定的排列顺序由肽键(酰胺键)联结成长链。肽键是由一个氨基酸残基的α-羧基和另一个氨基酸残基的α-氨其组成,如下所示:
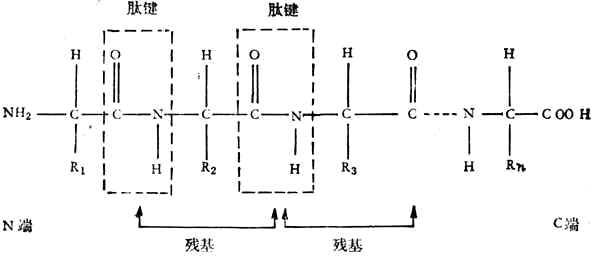
一个蛋白质分子由一个或几个肽链组成,每个链大约含有20到几百个氨基酸残基。肽链的氨基端称为N-端、羧基端称为C-端。蛋白质有一级结构、二级结构、三级结构、四级结构。一级结构只指肽链中氨基酸排列的顺序,二至四级结构表明主、侧链空间排列的关系。分子量超过1,000,000的蛋白质都有四级结构。
按照氨基酸侧链及氨基与羧基的数量,可将20种氨基酸分为三类(表2-1)。
这20种氨基酸在体内能参与蛋白质合成,都是人体所不可缺少的。其中异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯丙氨酸、苏氨酸、色氨酸、缬氨酸、组氨酸(表2-1)9种,在体内不能自行合成,或合成速率不能满足机体需要,必须由食物供给。这些氨基酸称为必需氨基酸。9种中的组氨酸是婴幼儿必需氨基酸,婴儿缺乏时患湿疹。其余11种在体内能自行合成,称为非必需氨基酸。但是半胱氨酸和酪氨酸在体内能分别由蛋氨酸和苯丙氨酸合成,这两种氨基酸如果在膳食中含量丰富,则有节省蛋氮酸与苯丙氨酸两种必需氨基酸的作用,因此有时称为半需氨基酸。
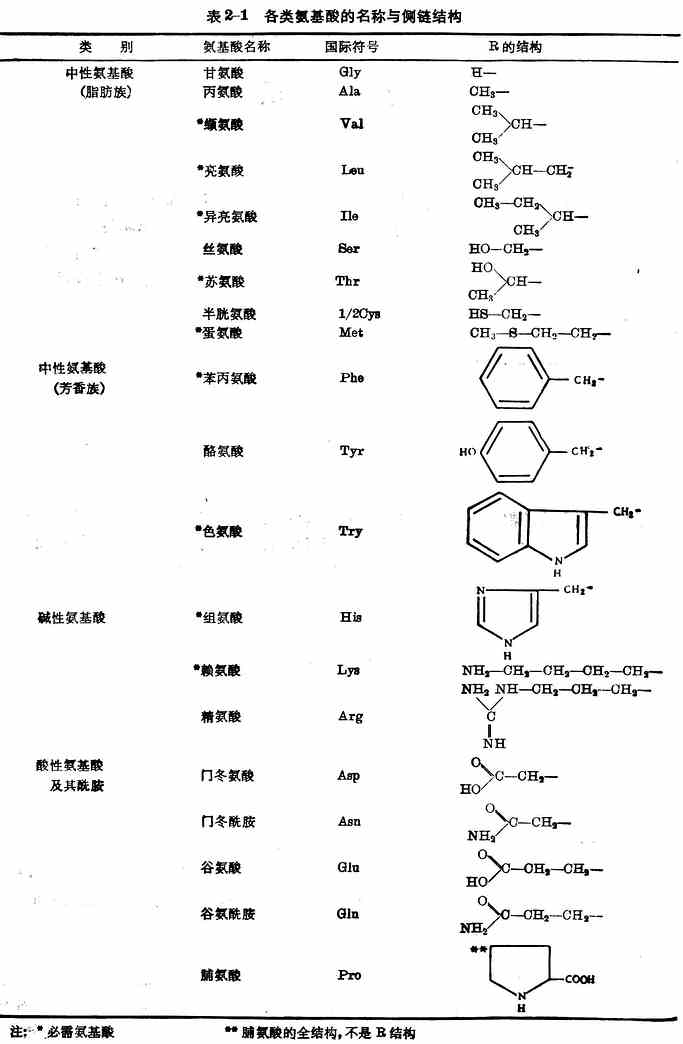
注:*必需氨基酸 **脯氨酸的全结构,不是R结构
蛋白质合成后,分子中某些氨基酸的衍生物。如两个半胱氨酸可借二硫键结合形成一个胱氨酸;胶原中的赖氨酸可羟基化成为羟赖氨酸;肌肉蛋白中的组氨酸经甲基化合成3-甲基组氨酸等。这些衍生物或者被排泄或继续分解代谢,不能再合成蛋白质。
从氨基酸的结构看,除甘氨酸外,其余氨基酸的α-碳原子都是不对称的,因而都具有旋光性。将α-碳原子的构型和甘油醛比较,可以见到蛋白质中的氨基酸都是L型的。L型和D型氨基酸的代谢反应不同,人体能利用所有的L型氨基酸而对D型的仅限于蛋氨酸和苯丙氨酸。
氨基酸分子上含有氨基和羧基,故称两性电解质,每一种氨基酸都有特定的等电点。氨基酸能与金属离子或酸生成盐、与醇生成酯、与有机酸形成酰胺化合物。氨基酸分子上还含有不少特殊基团,可与种种物质进行化学反应,参与机体代谢作用。在生化检验中,氨基酸能与某些试剂生成有色化合物,构成氨基酸定性、定量测定的基础。如大多数氨基酸与茚三酮反应生成蓝紫色化合物。
蛋白质由氨基酸组成,除具有与氨基酸相似的化学性质外,还有胶体性质和凝固、变性等现象。蛋白质颗粒大,且表面带有许多极性基团,在溶液中有高度的亲水性。因此蛋白质水溶液是一种较稳定的亲水胶体。少量的亲水胶全可以和大量水分结合,形成各种流动性不同的胶体系统,这就形成了各种组织细胞不同的形状、弹性和粘度。
蛋白质的分类方法很多。为了从不同角度了解蛋白质的概况,现将几种分类方法简介如下。
按照蛋白质中必需氨基酸的含量分类:
(1)完全蛋白 蛋白质组成中含有全部的人体必需氨基酸,如酷蛋白、卵蛋白。
(2)不完全蛋白 蛋白质组成中缺乏一种或几种人体必需氨基酸,如白明胶。
按照蛋白质的结构和溶解度分类:
(1)简单蛋白 包括动、植物组织中的白蛋白、球蛋白和植物组中的谷蛋白、麦醇溶蛋白,还有动物组织中含碱性氨基酸比较多的鱼精蛋白、组蛋白。
(2)硬蛋白 包括溶解度最低、不易消化的毛发、指甲、蹄、角中的角蛋白和皮肤、骨胳中的胶原蛋白、弹性蛋白。
(3)结合蛋白 包括在蛋黄中与磷酸组成的磷蛋白、与脂肪或类脂组成的脂蛋白和在骨胳、肌腱、消化液中与糖结合的粘蛋白、糖蛋白,与核酸、血红素、金属结合的核蛋白、血红蛋白、金属蛋白等。
按照蛋白质的功能分类:
(1)活性蛋白 包括在生命活动过程中一切有活性的蛋白质:如酶、激素蛋白、输送和储存蛋白、肌动蛋白、受体蛋白等。
(2)非活性蛋白 包括不具活性的、担任生物保护和支持作用的蛋白质:如胶原、角蛋白、弹性蛋白等。
以上各种分类方法都有一定的局限性,随着科学研究的发展,将不断补充修正。
2.2.2 游离氨基酸代谢库
体内氨基酸有结合型和游离型两种。结合型的浓度平均为2mol,而游离型约0.01mol,为结合型的0.5%。从幼年大鼠组织中氨基酸的分布看出,游离型必需氨基酸在组织和血浆中的浓度都很低,而丙氨酸、谷氨酸、谷氨酰胺和甘氨酸四种非必需氨基酸在组织中较高、血浆中则低(表2-2)。说明这几种非必需氨基酸能广泛在细胞内合成和储留。将体内游离必需氨基酸的浓度与大鼠每日氨基酸需要量比较(表2-2),游离氨基酸库每日必须转换数次才能满足大鼠生长的需要量。
表2-2 幼鼠(50g)体内氨基酸浓度和必需氨基酸需要量
| 蛋白质 | ||
| g·100g-1食物* | KJ·100kJ-1食物** | |
| 苹果 | 0.3 | 2.8 |
| 稻米(上白梗) | 6.7 | 7.8 |
| 带鱼 | 18.1 | 52.1 |
| 小麦粉(富强粉) | 9.4 | 10.7 |
| 土豆 | 2.3 | 11.9 |
| 花生米 | 26.2 | 19.2 |
| 瘦猪肉 | 16.7 | 20.2 |
| 鸡蛋 | 14.7 | 34.6 |
| 黄豆 | 36.3 | 35.2 |
| 豆腐(北) | 7.4 | 41.1 |
| 牛肉 | 20.1 | 46.7 |
血浆游离氨基酸经细胞膜进入组织细胞。在细胞上膜上具有转运中性、碱性、酸性各种类别氨基酸的载体,各类中不同氨基酸之间具有相互竞争的作用。
氨基酸在体内代谢途径可以归纳为三种:①掺入组织蛋白。经过一段时间后,随着组织蛋白的分解,又重入游离氨基酸库;②进行分解代谢。其碳架形成CO2呼出、或转化为糖原和脂肪蓄积,其氨基形成尿素排出;③合成其他含氮化合物,如嘌呤碱、肌酸、肾上腺素。这些物质继续降解不再返回游离氨基酸库。此外,还合成其他非必需氨基酸。
2.2.3 氨基酸转变为生理活性物质
氨基酸在体内主要是用来合成蛋白质,少量用于合成其他一些有生理活性的物质。
合成非必需氨基酸:酪氨酸和半胱氨酸分别由苯丙氨酸和蛋氨酸衍生而来,其他非必需氨基酸可由柠檬酸循环所产生的α-酮戊二酸或其他氨基酸与酮酸形成(图2-1)。
上述合成不普遍存在于各种组织,如苯丙氨酸只在肝脏受羟化酶催化而形成酪氨酸。
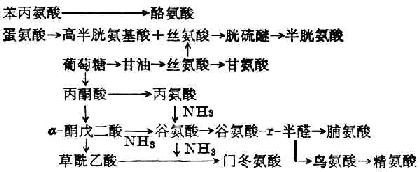
图2-1 非必需氨基酸的合成
嘌呤和嘧啶的生物合成:嘌呤和嘧啶碱可从食物供给,也能在体内自行合成。合成的主要原料是门冬氨酸、谷氨酰胺、甘氨酸等。
肌酸和肌酸酐的生物合成:肌酸由食物供给,也可以在体内从蛋氨酸、甘氨酸和精氨酸合成。肌酸由血液送至肌肉,被主动吸收,每天转换率为2%。体内大部分肌酸以肌酸和磷酸肌酸的形式储于骨胳肌。在静止的肌肉中则以磷酸肌酸为主,而在疲劳的肌肉中,磷酸肌酸浓度却很低。这是由于磷酸肌酸在磷酸肌酸转移酶的作用下,转变为肌酸和ATP的结果:

这个反应使肌肉在无氧条件下,能从磷酸肌酸获得附加的但数量有限的ATP。不论肌酸或者磷酸肌酸主要通过非酶脱水反应缓慢而不可逆地形成肌酸酐。肌酸酐不被利用,进入血液随尿排出,每日肌酸酐生成的量相当恒定,约为总肌酸库的1.7%。
2.2.4 蛋白质的生物合成和周转
蛋白质有高度的特异性。食物蛋白必须经过消化水解成为氨基酸而吸收,再合成人体所需要的各种蛋白质。蛋白质的合成体系主要由信使核糖核酸(mRNA)、转运核糖核酸(tRNA)、核糖核蛋白体核酸(rRNA)和某些蛋白质因子共同组成。mRNA是蛋白质合成的模板,tRNA是搬运氨基酸(原料)的工具,rRNA相当于装配机,促进氨基酸相互以肽键相结合。各种氨基酸在各自的搬运工具携带下,在装配机上按照模板的要求有次序地相互结合,生成具有一定氨基酸排列顺序的特定多肽链。合成后的多肽链,有的经过一定处理,有的与其他多肽链、糖、脂质等结合后形成具有生物活性的蛋白质。当合成原料(特别是必需氨基酸)供给不足时,可引起细胞内蛋白质合成减缓或停止。
每日蛋白质合成的量取决于生长、合成各种酶和修补组织细胞的需要。各种组织细胞合成与分解的速率差异很大,如小肠粘膜每1~2天更新一次而红细胞的寿命则约为120天;又如用同位素研究表明每天能合成血浆白蛋白10g、纤维蛋白2g,而幼年大鼠骨胳中胶原的生物半寿期却长达300天。用给予人体标记15N氨基酸方法估计不同年龄组成蛋白质合成的速率,得出体重约70kg的成年男子每日蛋白质合成量大于200g(表2-3)。这个数量超过成人每日蛋白质需要量或摄入量若干倍,因而可以理解陈旧蛋白质分解产生的氨基酸仍能用于蛋白质的再合成。
表2-3 不同年龄组总蛋白质合成率
| 年龄组 | 人数 | 体重(kg) | 年龄(范围) | 总蛋白质合成率(g.kg-1.d-1) |
| 新生儿(早产) | 10 | 1.94 | 1~46天 | 17.46 |
| 婴儿 | 4 | 9.0 | 10~20月 | 6.9 |
| 青年 | 4 | 71 | 20~23岁 | 3.0 |
| 老年 | 4 | 56 | 69~91岁 | 1.9 |
2.2.5 氨基酸的降解
各种氨基酸按照特定的化学反应进行降解。图2-2表明大鼠体内氨基酸降解的主要场所和产物。

图2-2 氨基酸主要降解场所与产物
有7种必需氨基酸主要在肝脏降解,其余异亮氨酸、亮氨酸、缬氨酸3种必需氨基酸(支链氨基酸)主要在肌肉中以及肾、脑中降解。支链氨基酸在肌肉中经转氨基作用变为丙酮酸和谷氨酸,继而分别形成丙氨酸和谷氨酰胺,再经血循环分别送到肝脏和肠。在肠壁转变为丙氨酸和谷氨酸。丙氨酸经门静脉送入肝脏,其氨基形成尿素、碳架经糖原异生作用转为糖(图2-3)。
尿素的形成几乎全部局限在肝脏中,因肝脏是唯一含有精氨酸酶的组织。首先是氨和CO2合成氨甲酰磷酸,然后经过瓜氨酸、精氨(酸代)琥珀酸、精氨酸等一系列合成反应(图2-4),最后精氨酸在精氨酸酶的催化下分解为尿素和鸟氨酸。鸟氨酸重返尿素合成的循环,尿素随尿排出。
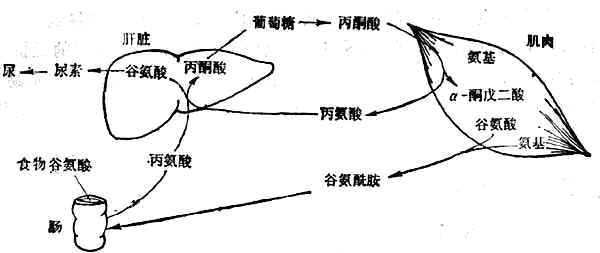
图2-3 葡萄糖-丙氨酸循环
CO2+NH3+ATP
↓
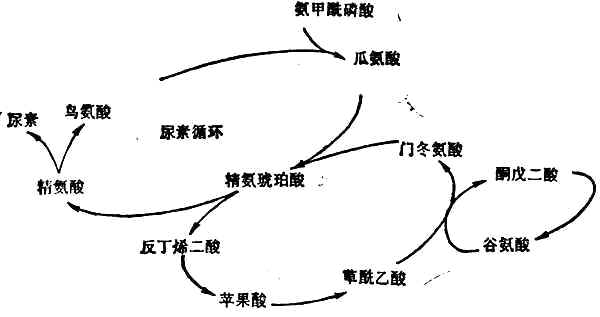
图2-4 尿素合成的途径
尿氨是蛋白质代谢的最终产物之一,在肾脏合成。由血浆送来的谷氨酰胺,在肾脏的近曲小管上皮细胞中,经谷氨酰胺酶催化水解为氨和谷氨酸盐。谷氨酸盐在谷氨酸脱氢酶的催化下,又产生氨和α-酮戊二酸。氨随尿排出;α-酮戊二酸经糖原异生作用形成葡萄糖,送入血循环重新利用。在饥饿或糖尿病等发生酸中毒的情况下,尿氨增多,肾脏既排泄氨又成了供给葡萄糖的场所。氨的形成也使身体保存了钠离子,否则钠离子将用于中和酸而被排出。
2.3 蛋白质的生理功用
蛋白质是构成人体组织的主要成分,是供给氮的唯一来源,其含量约占人体总固体量的45%。。人体的一切细胞组织都由蛋白质组成。许多具有重要生理作用的物质,缺少蛋白质就不存在。如有催化作用的酶;调节各种代谢过程的蛋白激素;输送各种小分子、离子、电子的运输蛋白;肌肉收缩的肌动蛋白;有防御功能的免疫球蛋白;构成机体支架的胶原蛋白等。
在一般情况下供给热能不是蛋白质的主要功用。但是在组织细胞不断更新过程中,蛋白质分解成氨基酸后,有一小部分不再利用而分解产热;也有一部分吸收的氨基酸,由于摄食过多或不符合体蛋白合成的需要,则氧化产热。人体每天所需热能大约有10~15%来自蛋白质。在特殊情况下,当糖和脂肪摄入不足时,蛋白质用于产生热能。
机体储存蛋白质的量很少,在营养充足时,也不过只有体蛋白总量的1%左右。这种蛋白质称为易动蛋白,主要储于肝脏、肠粘膜和胰腺,丢失后对器官功能没有改变。当膳食蛋白缺乏时,组织蛋白分解快、合成慢,导致如下一系列生化、病理改变和临床表现:肠粘膜和消化腺较早累及,临床表现为消化吸收不良、腹泻;肝脏不能维持正常结构与功能,出现脂肪浸润;血浆蛋白合成发生障碍;酶的活性降低,主要是黄嘌呤氧化酶和谷氨酸脱氢酶降低;由于肌肉蛋白合成不足而逐渐出现肌肉萎缩;因抗体合成减少,对传染病的抵抗力下降;由于肾上腺皮质功能减退,很难克服应激状态;胶原合成也会发生障碍,使伤口不易愈合;儿童时期可见骨骼生长缓慢、智力发育障碍。蛋白质长期摄入不足,可逐渐形成营养性水肿,严重时导致死亡。
2.4 膳食蛋白质的利用
2.4.1 蛋白质的消化与吸收
食物蛋白在胃液消化酶的作用下,初步水解,在小肠中完成整个消化吸收过程。胃蛋白酶原从胃底部和幽门部的主细胞分泌,在胃酸和已存在的胃蛋白酶作用下,释出一部分多肽,形成具有活性的胃蛋白酶。胃蛋白酶的作用较弱、专一性较差,除粘液蛋白外,只能促进各种水溶性蛋白质水解成为多肽,主要水解苯丙氨酸、酪氨酸和亮氨酸组成的肽键。
胰液中有胰蛋白酶、胰液乳蛋白酶、弹性蛋白酶等内肽酶和羧基肽酶A与B等外肽酶。胰酶催化蛋白质水解的作用和专一性都较强。作过胃切除术的人,食物蛋白未经胃蛋白酶的作用,其消化率并不受到严重的影响。胰蛋白酶作用于有碱性氨基酸残基的羧基组成的肽键;胰凝乳蛋白酶主要作用于有芳香族氨基酸残基的羧基组成的肽键;弹性蛋白酶作用于有脂肪族氨基酸残基的羧基组成的肽键;羧基肽酶A作用于中性氨基酸残基C端的肽键;羧基肽酶B作用于碱基氨基酸残基的C端的肽键(图2-5)。
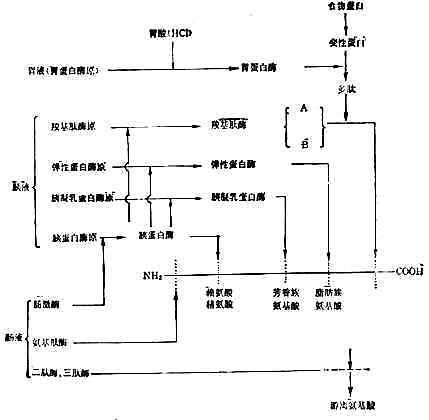
图2-5 胃肠道内蛋白质的消化(根据Gilter修改)
初分泌的各种胰酶都是无活性酶原,排至十二指肠后才被激活发挥作用。胰蛋白酶原被小肠上皮细胞刷状缘表面的肠激酶激活,失N端六肽变成胰蛋白酶。胰蛋白酶再激活胰凝乳蛋白酶原、弹性蛋白酶原和羧基肽酶原,使变成相应的酶(图2-5)。胰蛋白酶原的分泌受肠内食物蛋白的影响,当胰蛋白酶与食物蛋白结合完毕后,多余的胰蛋白酶能抑制胰腺再分泌。
胰酶水解蛋白的产物,仅1/3为氨基酸,其余为寡肽(10个氨基酸以下的肽链)。肠液中肽酶极少,而在肠粘膜细胞的刷状缘和胞液中,分别含有多种寡肽酶,能从肽链的N端逐步水解肽链,称之为氨基肽酶。刷状缘含有的酶能水解2~6个氨基酸组成的肽;肠液中的酶主要水解二肽、三肽。一般认为正常情况下,四肽以上的肽链遇到刷状缘,先水解为三肽或二肽,吸收入细胞后再进一步分解为氨基酸。
L-氨基酸和二、三肽主要通过耗能需钠主动转运从肠壁吸收。在肠粘膜细胞膜上,具有吸收不同种类氨基酸和二、三肽的高度专一性的转运体系。D-氨基酸可能与相应的的L-氨基酸利用同一转运系统,但它和该系统的亲和力远不及L-氨基酸。在蛋白质代谢产物的吸收中,二、三肽的吸收速率比氨基酸快,中性和较为亲水的氨基酸的吸收速率又比碱性和较为疏水的氨基酸为快。
肠道中的蛋白质并非全部来自膳食,还有来自脱落粘膜的上皮细胞和消化酶等内源性蛋白质。据估计成人每天有内源性蛋白35~130g(蛋白质摄入量低时少些)参与体内蛋白质代谢。内源性蛋白不受烹煮和胃酸的作用,而且表面被肠液粘蛋白保护,故较难消化。大部分内源性蛋白质需进入回肠才能充分消化吸收。在回肠末段和大肠中细菌的酶也能分解蛋白质,但人的结肠不能吸收氨基酸,生成的氨基酸只能随粪便排出。
2.4.2 肝脏的作用
摄食蛋白质后,门静脉血中氨基酸的浓度和模式都有改变,但体循环血中氨基酸的变化不大。这是由于肝脏是必需氨基酸(支链氨基酸除外)进行分解代谢的主要场所,肝脏能控制吸入的氨基酸,并能按照机体的需要调节其代谢速率。
大量进食氨基酸后,多余的氨基酸大部分由肝脏降解为尿素,小部分在肝脏用于合成蛋白质。如Elwyn(1970)给狗大量肉食(140g)后,吸入的氨基酸约57%降解为尿素,14%合成肝脏蛋白,6%合成血浆蛋白,其余23%进入体循环。
氨基酸进入肝脏过多时,可以通过酶的作用加以控制。正常情况下,肝脏中分解氨基酸的酶含量相对较少,大量供给氨基酸时,酶的含量适应性地增加,使超过身体需要量的氨基酸分解破坏。
肝脏中蛋白质的合成量,取决于氨基酸摄入量和氨基酸的模式。这可从核蛋白体的合成反映出来。当氨基酸摄入量很少或不平衡时,多核蛋白体解聚为低核蛋白体和单核蛋白体,核糖核酸分解;氨基酸摄入量充足和比例适宜时则相反。
2.4.3 血液氨基酸浓度的调节
血浆游离氨基酸是氨基酸在各组织间转运的主要形式。肝脏通过维持血浆氨基酸的浓度,调整不同摄入量和组织需要量之间的平衡。正常成人血浆游离氨基酸总浓度为350~650mg·L-1,昼夜周期性相差约30%,个别氨基酸昼夜差一般不大于50%。
血浆氨基酸是受肝脏调节,但当氨基酸摄入量超过代谢限度时,血浆氨基酸的浓度会急剧上升。如分别给断乳大鼠和成年大鼠以含不同量色氨酸的饲料,当色氨酸含量超过生长或维持需要的最大量(断乳鼠色氨酸需要量占饲料0.1%、成年鼠色氨酸需要量占饲料0.03%)时,血浆色氨酸浓度增高。这种方法曾用于测定人体必须氨基酸的需要量,如测得成人色氨酸的需要量为3mg/kg体重。这与用氮平衡法得出的需要量结果一致。然而,对其他氨基酸(如赖氨酸)的测定没有得到理想的结果。
血浆氨基酸浓度也受膳食糖的影响。在进食糖后,胰岛素的分泌增多。在胰岛素的作用下,大多数氨基酸进入肌肉,而使血浆中的浓度下降。其中以支链氨基酸的下降最为明显,在进食一次葡萄糖后可降低40%;而某些氨基酸(如色氨酸)受影响很少。
氨基酸进入脑细胞的量,也决定于血浆中其他竞争性氨基酸的浓度。给大鼠色氨酸后,脑中游离色氨酸的含量增高,5-羟色胺增多;给大鼠进食糖,引起血浆中支链氨基酸大幅度下降,促进色氨酸进入脑组织,同样使脑中5-羧色胺增高。
上述作用不仅与5-羧色胺的代谢有关,而且在病理情况下,对脑功能的影响也有重要意义。肝脏硬化、功能不全时,在肠道细菌作用下产生的胺和氨,不能正常地在肝脏分解与转变,而是由循环通过血脑屏障进入脑细胞。如苯丙氨酸在细菌作用下变成苯乙胺,到脑中转变为β-羧酪胺(樟胺),成为与儿茶酚胺竞争的假神经递质。在正常情况下,能被肝脏调节的氨基酸(如色氨酸、苯丙氨酸),这时也不再受控制,随着血浆进入脑组织。另外,在正常情况下,主要在肝脏降解的胰岛素也不再分解。血浆胰岛素含量增高,促进支链氨基酸进入肌肉;血浆支链氨基酸下降,又增加了色氨基酸进入脑细胞的比例。上述种种因素能使脑组织中5-羟色胺产生过多,引起肝昏迷。根据以上论点,给肝昏迷患者以含高支链氨基酸的膳食或输液,能有效地解除症状。
2.4.4 骨骼肌的作用
骨胳肌是身体最大的组织,约占体重的45%。因此,在蛋白质代谢中,肌肉氨基酸的代谢占相当重要的位置。肌肉是氨基酸代谢的场所,也是支链氨基酸代谢的主要场所,在肌肉氨基酸代谢中,胰岛素起重要的调节作用。它能促进氨基酸,特别是支链氨基酸,进入肌肉组织,促进肌肉蛋白的合成,并减缓其分解。肾上腺皮质激素和胰岛素的作用则相反。
测定肌肉蛋白代谢的方法主要有两种,即比较肌肉动静脉血中氨基酸含量的差别和测定尿中3-甲基组氨酸的排出量。
禁食者肌肉中释放大量丙氨酸和谷氨酰胺,其量相当于70kg体重的男子每日丢失75g肌肉蛋白。丙氨酸是由葡萄糖分解产生的丙酮酸与氨基酸分解释出的氨基合成的,通过血液送入肝脏,在肝脏经糖原异生成形成葡萄糖和尿素。前者返回肌肉,重新利用,形成了葡萄糖-丙氨酸循环,后者随尿排出(图2-3)。是氨基酸分解产生的氨基在血液中运输的形式。谷氨酸胺主要进入肠壁组织和肾脏,在肠壁中再转变为丙氨酸而后进入肝脏;在肾脏中分解释出氨,成为尿氨的主要来源,同时也进行糖原异生作用。
3-甲基组氨酸是肌肉中肌动蛋白、肌球蛋白分解时,3-甲基组氨酸的排出量曾用来研究食物成分对肌肉蛋白分解速率的影响。给幼年大鼠普通的、缺乏蛋白质和缺乏热能与蛋白质的三种饲料。发现蛋白质缺乏组,尿中3-甲组氨酸的排出量很快减至原排出量的1/5,补以蛋白质后排出量增高;热能与蛋白质缺乏组,尿中3-甲基氨基酸开始增多,随后逐渐下降。实验表明,蛋白质缺乏时,肌肉蛋白停止分解,而在热能与蛋白质缺乏时,肌肉蛋白先加速分解,然后减慢。印度营养不良的儿童,3-甲基组氨酸的排出量低,营养补充后则升高。减肥者长期禁食,尿中3-甲基组氨酸排出量亦逐渐下降。
尿中3-甲基组氨酸的排出量也受年龄和激素的影响。新生儿每公斤体重的排出量高于成年人,老年人的排出量又比中、青年为低。
2.4.5 氮平衡
体内氮代谢的最终产物主要随尿排出,汗液和脱落的皮屑中含有少量含氮化合物,还有微量的氮随毛发、鼻涕、月经、精液等丢失。肠道中未被吸收的含氮化合物从粪排出。
尿中主要的含氮化合物有尿素、氨、尿酸和肌酸酐,其量随蛋白质的摄入而异(表2-4)。
表2-4 成人不同膳食每日尿氮排出量(g)
| 尿氮来源 | 高蛋白膳 | 低蛋白膳 | 禁食 | |
| 第1天 | 第2天 | |||
| 总氮 | 16.80(100) | 3.60(100) | 10.51(100) | 8.71(100) |
| 尿素氮 | 14.70(87.5) | 2.20(61.7) | 8.96(85.1) | 6.62(75.4) |
| 氨氮 | 0.49(3.0) | 0.42(11.3) | 0.40(3.8) | 1.05(12.0) |
| 尿酸氮 | 0.18(1.1) | 0.09(2.5) | 0.12(1.1) | 0.17(1.9) |
| 尿肌酸酐氮 | 0.58(3.6) | 0.60(17.2) | 0.44(4.2) | 0.39(4.4) |
| 其他氮 | 0.85(4.9) | 0.27(7.3) | 0.59(5.6) | 0.54(6.1) |
注:()内为尿总氮的%
普通膳食时,尿素氮占总氮量80%以上;低蛋白膳时,尿素氮降低;饥饿时,氨氮增高。尿肌酸酐的排出量似乎与膳食蛋白的含量无关。
组织蛋白的分解代谢和合成代谢处于动态平衡,这种平衡可用氮平衡表示:
B=I棧?/FONT>U+F+S)
氮平衡(B)是摄入氮量(I)和排出氮量[尿氮(U)、粪氮(F)、皮肤(S)]的差数。成年人摄入和排出的氮量大致相等,B等于或接近零(摄入氮的±5%以内),称为氮平衡;儿童在生长发育时期,有一部分蛋白质在体内储留,B为正数,称为正氨平衡;衰老、短暂的饥饿或某些消耗性疾病,排出氮量大于摄入氮量,B为负数,称为负平衡。
氮的摄入量和排出量可用实验方法测得。在测定中,由于食物未完全消化,摄入量的计算往往偏高;由于样品丢失或忽略不计,排出量的计算往往偏低。两者误差的总和可使摄入量和排出量相差10~15%。
氮平衡受热能摄入量的影响,热能有节省蛋白质的作用。如1973年FAO/WHO专家委员会报告,给受试者蛋白质0.57g·kg-1体重,当热能供给量充裕时,出现正氮平衡;而当热能供给量在维持水平时,出现负氮平衡。氮平衡还受生长激素、睾酮、皮质类固醇和甲状腺素等激素的影响。这些激素有促进蛋白质合成的作用,或促进蛋白质分解、抑制合成的作用。
2.5 蛋白质和氨基酸的需要量
人类对蛋白质需要量的研究,虽已有100多年的历史,但理论上的发展缓慢。50年代前后,Rose等人对人体各种必需氨基酸需要量进行了一系列的测定,以后国联和联合国曾多次召集专家讨论和修订蛋白质和氨基酸的需要量,有关的研究工作至今仍在进行中。
2.5.1 蛋白质的需要量和供给量
营养素的需要量是维持人体正常生理功能和健康所必需的最低量;供给量是能满足人群中绝大多数人需要的摄取量,是根据需要量制订的。蛋白质需要量的测定方法有要因加算法、氮平衡法两种。
要因加算法(factorial method)是用测定必需丢失氮(obligatory nitrogen loss)来确定蛋白质需要量的方法。人(或动物)在进食无蛋白膳的条件下所丢失的内源氮,包括尿、粪氮和皮肤氮等,称为必需丢失氮。为维持健康,每日丢失的氮必须给予补偿,从补偿量可以得出蛋白质的需要量。人从摄入普通膳改为无氮膳后,氮的排出量会逐日下降。约8~14天后达到稳定的最低值,此值即内源氮。FAO/WHO专家委员会在1965年介绍了要因加算法,1973年作了修改,其测定值和蛋白质供给量的计算见表2-5。
表2-5 用要因加算法计算成年男子蛋白质供给量(FAO/WHO1973)
| 平均必需丢失氮(mg·kg-1·d-1) | |
| 尿氮 | 37 |
| 粪氮 | 12 |
| 皮肤氮 | 3 |
| 其它氮 | 2 |
| 总氮 | 54 |
| 个体差异增加(%) | 30 |
| 按卵蛋白计算增加(%) | 30 |
| 氮供给量(mg·kg-1·d-1) | 91 |
| 蛋白质供给量(g·kg-1·d-1) | 0.57 |
| 蛋白质供给量(g·70kg-1·d-1) | 40 |
平均必需丢失氮加上两个标准差(个体差异)可以得到满足97.5%人群需要的供给量,也可按照生物学个体差异的规律加上两个15%以计算供给量。此处按后者计算,54mg加上30%得70mg。为补偿丢失氮,用参考蛋白作用标准来换算蛋白质需要量。由于卵蛋白在常规大鼠实验中的利用率为95~98%,1965年用其作为天然参考蛋白,但以后在人体氮平衡实验中证明卵蛋白的利用率仅70%左右。因此,在1973年的计算中,为校正卵蛋白利用率的不足,在70mg氮上增加30%得91mg。以0.091g·kg-1体重氮乘上6.25,得蛋白质供给量0.57g·kg-1体重。有些国家在这种方法的基础上加以修改,提出本国蛋白的供给量。如美国(1980年)为0.8g·kg-1体重,日本(1980年)为1.18g·kg-1体重。
氮平衡法(nitrogen balance method)是在控制膳食中有同量蛋白质的情况下,求出达到维持氮平衡时的蛋白质摄入量,作为机体蛋白质的需要量。这种方法虽然古老,而且测定值又受体内蛋白质储备和热能摄入量的影响,但目前国际上仍作为测定人体蛋白质需要量的一种方法。1963年国际根据Sherman的氮平衡实验,提出成年人蛋白质需要量为1g/kg体重。王成发和陈学存对成年男子进行氮平衡实验,在热能供给充裕的情况下,蛋白质的需要量在0.9~ 1.0g·kg-1体重范围内。我国膳食以植物性食品为主,植物蛋白的生物价值稍低。因此,每日膳食中蛋质的供给量应按1.1g·kg-1体重,成年男子63kg体重为70g(1988年第五届全国营养学术会议修订)。儿童时期需要更多的蛋白质以保证生长发育,1岁以内婴儿蛋白质的需要量:人乳喂养者为2g·kg-1体重;牛乳喂养者3.5g·kg-1体重;混合喂养者4g·kg-1体重。1岁以后逐渐减少,直至成年人的1.1g·kg-1体重。妊娠期为保证母体和胎儿增长需要,在妊娠第4~6个月每日供给量增加15g、第7~9个月每日增加25g。乳母每日也增加25g。
2.5.2 必需氨基酸需要量
人体需要蛋白质,确切地说是需要蛋白中的氨基酸,因此测定氨基酸的需要量比测定蛋白质的需要量更有直接意义。
研究氨基酸需要量的方法是给实验对象先摄食缺乏某一种氨酸的食物,然后补充不同量的该种氨基酸。当达到氮平衡(成人)或促进生长发育(儿童)时,所需的最低量即该种氨基酸的需要量。Rose首先用氮平衡法得出成年男子各种氨基酸的需要量。以后,不少学者研究了不同年龄、性别的人群的必需氨基酸需要量。用氮平衡法得出的需要量一般选范围较大,现将Rose等人测定的需要量平均值列于表2-6。目前我国暂参照FAO/WHO(1973)数据,作为成年男子必需氨基酸需要量标准。
表2-6 人体必需氨基酸平均需要量(mg·kg-1·d-1)
| 婴儿(Holt) | 儿童10~12岁(Nakagawa) | 成年男子(Rose) | 成年女子(Hegsted) | 成人(FAO/WHO 1973) | |
| 组氨酸 | 25 | - | - | - | - |
| 异亮氨酸 | 111(5.8) | 28(7.0) | 10(3.3) | 10(3.3) | 10(2.9) |
| 亮氨酸 | 153(8.1) | 49(12.3) | 11(3.7) | 13(4.3) | 14(4.0) |
| 赖氨酸 | 96(5.1) | 59(14.8) | 9(3.0) | 10(3.3) | 12(3.4) |
| 蛋氨酸+胱氨酸 | 50(2.6) | 27(6.8) | 14(4.7) | 13(4.3) | 13(3.7) |
| 苯丙氨酸+酪氨酸 | 90(4.7) | 27(6.8) | 14(4.7) | 13(4.3) | 14(4.0) |
| 苏氨酸 | 66(3.5) | 34(8.5) | 6(2.0) | 7(2.3) | 7(2.0) |
| 色氨酸 | 19(1.0) | 4(1.0) | 3(1.0) | 3(1.0) | 3.5(1.0) |
| 缬氨酸 | 95(5.0) | 33(8.3) | 14(4.7) | 11(3.7) | 10(2.9) |
| 总计(除去组氨酸) | 680 | 261 | 81 | 80 | 83.5 |
()内数值是根据原表以色氨酸为1的计算值。
摘自White,PL et(1974):"Total ParenteralNutrition",p.65
前已提到胱氨酸和酪氨酸在体内可以分别由蛋氨酸和苯丙酸合成。摄入此两种非必须氨基酸可分别节省蛋氨酸和苯丙氨酸,即胱氨酸可代替30%蛋白酸、酪氨酸可代替50%苯丙氨酸。
人体蛋白质和必需氨基酸的需要量(按kg体重计),都随年龄的增长而下降,但必需氨基酸下降的幅度更大些。成人每公斤体重必需氨基酸的需要量仅约为婴儿需要量的1/8。将各年龄组必需氨基酸的平均需要量加上30%计算成为97.5%人群的需要量,再和相应年龄组的蛋白质需要量比较,分别得出必需氨基酸的需要量占蛋白质需要量的比值:婴儿为43%;儿童为36%;成人为19~20%。婴幼儿的需要量比成人高的理由是:婴幼儿除了满足维持的需要量(补偿内源氧化损失的氨基酸)外,还有生长发育的需要。
各种必需氨基酸除了要求数量足够,还要求互相间的比例(或称模式)恰当。因为人体细胞蛋白质的氨基酸有一定的比例,膳食蛋白所提供的各种必需氨基酸和这种比例相近,才能充分为机体所利用。如果缺乏其中的一种,则tRNA就不可能及时地将所需要的各种氨基酸全部带给rRNA,其他氨基酸得不到充分利用,蛋白质的合成也就不能顺利进行。表2-6括号内的数值列举了各个模式。实验证明不给或给过量的某种氨基酸,造成与适宜模式有较大的偏离时,都可引起受试动物发生代谢障碍或出现毒性症状。如每日饲料中增加2%蛋氨酸,可使动物生长迟缓,肝、脾、胰发生退行性变性,肾脏肥大等;而蛋氨酸供给不足,也可引起物肝脏坏死;赖氨酸不足,大鼠可出现脂肪肝;色氨酸不足,造成烟酸缺乏。
还应指出:热能和非必需氨基酸的供应必须充裕,才能使表2-6中列举的必需氨基酸的量能够满足机体构成组织蛋白的营养效能。
2.5.3 影响蛋白质需要量的因素
膳食热能有节省蛋白质的作用,热能供给不足,蛋白质将氧化产生热能。Callowag(1974)等发现供给氮7~8g,逐步增加热能时,氮的损失就减少;当热能供给达到12600kJ时,就得到正氮平衡。因而在营养支持时和研究蛋白质需要量的实验中,都必须注意在给时,就得到正氮平衡。还要配合足够的热能。热环境对蛋白质需要量的影响,意见不一致。Consolazio分析热适应者在38.7℃下进行中等体力劳动时,手臂汗液氮含量为241mg·L-1,因而认为人在热环境下进行中等体力劳动时,蛋白质的摄取量应在一般摄入量的基础上增加13~14%。但Ashworth测定6名牙买加热适应者的全身汗液,发现汗氮浓度不高;Weinen测定6名坦桑尼亚青年的汗液,发现汗氮每日最大丢失量只有0.5~1g;Thaper还发现当汗氮浓度增高时,尿氮含量会代偿性降低;因此,他们认为即使在热环境多汗的情况下,也不必增加蛋白质的供给量。
重体力劳动时,热能需要量增高。蛋白质摄入量随着膳食摄入量的增加而有所增高。体力劳动是否增加蛋白质的需要量,也有不同的意见。较多的看法倾向于在劳动尚不熟练的阶段或在运动训练时期,提高蛋白质的供给对修补组织和预防运动性贫血是有益的。Buskirk等(1972)认为某些可能发生挫伤的运动,如足球或摔跤,蛋白质需要量增至每日2.5g·kg-1体重。实验研究报道我国体操运动员蛋白质需要量是1.8g·kg-1体重,其中2/3是优质蛋白,蛋白质占总热能的12~14%;儿童或者少年运动员按单位体重计算,蛋白质的需要量比成年人高,9~11岁体操运动员的需要量为3g左右。已知剧烈的肌肉活动可增加红细胞的破坏。Yamaji通过实验证明,在运动实验开始时,红细胞、血红蛋白、血清蛋白都下降。下降持续时间的长短和蛋白质摄取量有关,如每天摄取蛋白质1~1.5g·kg-1体重,血红蛋白和血清蛋白降低后不易恢复。Yoshimura称这种运动期间出现的贫血为运动性贫血。他根据动物实验推测运动性贫血的机理是:剧烈运动时,可能由于肾上腺素的作用,使脾脏收缩释放出溶血因子以破坏红细胞。从红细胞游离出的血红蛋白可用于制造肌红蛋白和新的红细胞,以适应运动的需要。为了预防运动性贫血,Yoshimura提出在体力锻炼期间,蛋白质供给量应为每日2g·kg-1体重。
在失眠、精神紧张、生活节律改变等应激情况下,蛋白质需要量增加6~12%不等,但个体差异较大。
2.6 蛋白质营养状况的评价
评价蛋白质营养状况的指标主要有以下数种。
2.6.1 上臂肌围(arm muscle circumference,AMC)和上臂肌区(arm muscle area,AMA)
上臂肌围和上臂肌区是评价总体蛋白储存的较可靠的指标。假设上臂为圆筒,上臂骨径不计,测量上臂中点处的围长(AC)和三头肌部皮褶厚度(TSF),即可计算上臂肌围和上臂肌区。其计算式:
AMC(mm)=AC(mm)-3.14×TSF(mm)
AMA(mm2)=[AC(mm)-3.14×TSF(mm)]2/(4×3.14)
AMC评价标准:国际标准25.3cm(男)、23.2cm(女),日本24.8cm(男)、21.0cm(女)。测定值>90%标准值为正常。我国某单位根据1532舰艇人员(男)的测量,提出AMC≥237mm为正常,<237mm为缺乏;AMA≥4490mm2为正常,<4490mm2缺乏。
上臂肌围测算简便,评价结果和其他蛋白质营养状况的评价(总体K和肌肉CT)的结果有显著相关。但测量易有误差,由于上臂是纺缍形的,即使同一人操作,上臂围和皮褶厚度两处测量误差的合计可约达10%。此外,“上臂为圆筒形”“骨径不计”的假设是不妥当的。
2.6.2 血清蛋白
低蛋白膳可引起血浆蛋白合成降低。用血浆蛋白除去法(plasmaphresis)使动物丢失50%的血浆蛋白,再饲以高蛋白膳可在一日内迅速恢复其损失的1/3,并在二周内完全恢复到正常水平。如果血清总蛋白和白蛋白长期低于正常值,可以说明体蛋白不足。
血清蛋白中白蛋白(albumin,Alb)、前白蛋白(prealbumin,PreAlb)、运铁蛋白(transferrin,TFN)和视黄醇结合蛋白(retinol binding protein,RBP)主要都在肝脏合成。这几种血清蛋白浓度降低,可以认为是脏器蛋白缺乏、生化合成减低的缘故。
(1)白蛋白白蛋白是群体调查时常用的指标。人群调查发现平均血清白蛋白水平低,往往与膳食蛋白的摄入量不足有关。
Alb评价标准:>35g·L-1正常,28~34g·L-1轻度缺乏,21~27g·L-1中度缺乏,<21g·L-1严重缺乏。当白质蛋白浓度低于28g·L-1时,会出现水肿。
白蛋白测定样品易采集,方法简易。但白蛋白体库大(4~5g·L-1)、生物半寿期(20d)长,早期缺乏时不易测出。
(2)运铁蛋白运铁蛋白是输送铁的蛋白。和白蛋白比较,运铁蛋白体库较小、生物半寿期(8~10日)较短,故能及时地反映脏器蛋白急剧的变化。在高蛋白膳治疗时,血浆中浓度上升快,是判断治疗效果的良好指标。
TFN评价标准:2500~3000mg·L-1正常。1500~2000 mg·L-1轻度缺乏,1000~1500mg·L-1中度缺乏,<1000 mg·L-1严重缺乏(用放射免疫法测定)。
运铁蛋白的浓度又受铁的影响。当蛋白质和铁的摄取量都低时,其血浆浓度出现代偿性增高,在评价时应注意。
(3)前白蛋白前白蛋白的主要功能是运输甲状腺素。它的体库很小,生物半寿期1.9天。
PreAlb评价标准:157~296 mg·L-1为正常,100~150mg·L-1轻度缺乏,50~100 mg·L-中度缺乏,<50 mg·L-1严重缺乏。
在任何急需合成蛋白质的情况下,如创伤、急性感染,血清前白蛋白都迅速下降。因而从测试资料判断是否有蛋白质营养不良必须慎重。
(4)视黄醇结合蛋白视黄醇结合蛋白是运输维生素A醇的特殊蛋白。从肾小球滤过,在肾脏代谢,生物半寿期10h。是评价蛋白质营养不良急性变化的敏感指标。
RBP评价标准:2~76 mg·L-1为正常。此指标高度敏感,甚至在很小的应激情况下,也有变化,因而临床很少应用。肾脏有病变时,血清RBP浓度升高。
此外,血清总蛋白、球蛋白也用作评价指标。我国正常成年人血清总蛋白的正常值是65~80g·L-1、白蛋白/球蛋白的比是1.5~2.5:1。但这两项指标特异性差,尤其是球蛋白,在有感染和寄生虫病时都增高。
应该看到,血清蛋白浓度不仅与蛋白质摄取和合成有关,也受分解、血管内外运行、渗出和细胞外液增加等因素的影响。因此,在评价时必须综合分析,避免过于简单地下结论。
2.6.3 血清氨基酸比值(serum amino acid ratios,SAAR)
在蛋白质营养不良时,可能由于适应性代谢的结果,血清游离氨基酸的模式发生变化。蛋白质营养不良的儿童,空腹血亮氨酸、异亮氨酸等必需氨基酸和酪氨酸、精氨酸等非必需氨基酸减少;而其他非必需氨基酸正常或增高。
SAAR=(甘氨酸+丝氨酸+谷酰胺+牛磺酸)/(异亮氨酸+亮氨酸+缬氨酸+蛋氨酸)
评价标准:SAAR〈2为正常,〉3蛋白质营养不良。
此指标测试仪器复杂,而且受试者必须在热能摄入充足而蛋白质不足的条件下,才有意义,因而不常采用。
2.6.4 尿肌酸酐(urinary creatinine)
尿肌酸酐来自肌酸的磷酸肌酸,而后两者储于骨胳肌(参看2.2.3节)。因此,测定24h尿肌酸可作为瘦体组织营养状况评价的指标。人群调查表明瘦体组织和尿肌酸酐两者有非常显著的相关。但由于肌酸来自食物和体内合成两个部分,用尿肌酸评价廋体重约有0.3~0.5%的误差。在测定技术上,24h尿样很难准确收集,即使收尿时间有15min之差,也能使测定结果产生1%误差。
2.6.5 尿肌酸酐/身高指数(urinaryceratinine/height index,CHI)
尿肌酸酐/身高指数是24h尿肌酸酐(A)和同性别、同身高的成年人24h预期的尿肌酸酐(B)的比值:
CHI=A/B×100
A=受试者24h尿肌酸酐
B=与受试者同身高中等体型理想体重的人预期的24h尿肌酸值[或采用肌酸酐系数23mg·kg-1(男)、18 mg·mg-1(女)体重计算]。
CHI评价标准:60~80%中度缺乏,<60%严重缺乏。
这项指标评价体蛋白营养状况还存在一些问题:①24h尿难于准确收集;②理想体重不适用,有些病人正常时的体重不符合理想体重;③标准没有年龄差别,而实际上尿肌酸酐随年龄增长而降低。因而临床应用价值不大。
2.6.6 发根的生化和形态检查
头发生长时的毛基质细胞有高度合成蛋白质的能力、增殖快。检查头发的生化和形态可以作为早期判断蛋白质营养不良的指标。据Zain等人的调查,335名儿童发根中DNA和可溶性蛋白质随蛋白质营养不良的发展而有进行性的减少。Bradfield(1970)观察8名健康男子蛋白质的摄取和头发生长的关系。在摄食无蛋白膳15天后,见到发根球部明显萎缩,而血清蛋白尚未见到异常。Smelser介绍用拔毛发计测定拔发所需的功,可以反映蛋白质营养状况。拔毛用力度和体重、上臂肌围、血清白蛋白有显著相关。
上述指标,种类虽然很多,但各有不足之处,实际应用还须结合膳食史和临床观察进行综合评价。
2.7 食物蛋白质
2.7.1 食物氮的存在形式
食物来源于动、植物,其中氮的存在形式有很大差别。肉类绝大部分的氮以蛋白质形式存在,仅有少量游离氨基酸或肽以及核酸、磷脂氮、肌酸、鹅肌肽;鱼类则非蛋白氮含量丰富,约占总氮量的10~30%;乳氮约20%属于非蛋白氮。植物性食物含氮化合物的成分差异更大,种子类几乎95%的氮存在于蛋白质,而根茎类如土豆、胡萝卜等,蛋白质少于50%,多数氮以肽和游离氨基酸的形式存在,特别是土豆富含谷氨酰胺和门冬氨酸。此外,植物组织中含有不少非蛋白氨基酸,这些氨基酸有些能在体内代谢,而多数原样不变从尿排出;还有少量是有毒的,如刀豆中的刀豆氨酸、蚕豆中的β氰基丙氨酸。新的蛋白质来源如单细胞蛋白含核蛋白很高,其量可达蛋白质总量的50%。由于核酸在人体内最终代谢产物为尿酸,大量食用可引起血浆尿酸浓度增高,易形成尿结石和痛风症。因此,单细胞蛋白不经去核酸处理,不宜作为人类食物的来源。
食物中蛋白质的含量一般采用凯氏定氮法进行测定,然后换算成蛋白质的量。动、植物性食物蛋白的含氮量约为15.7~19%,平均16%。将测得的氮值乘以6.25(蛋白质换算系数),即得该食物的粗蛋白的含量。需要比较准确地计算时,可采用不同的换算系数(表2-7)。
表2-7 氮换算成蛋白质的换算系数
| 换算系数 | |
| 面粉(中或低出粉率) | 5.70 |
| 全麦 | 5.83 |
| 大米 | 5.95 |
| 花生 | 5.46 |
| 黄豆 | 5.71 |
| 芝麻 | 5.30 |
| 乳类 | 6.38 |
这种计算方法是按食物总氮全部以蛋白质的形式存在而计算的,对含非蛋白氮高的食物来说,蛋白质的计算的值无疑过高。因此用定氮法测得的蛋白质,称之为粗蛋白。
2.7.2 常用食物的蛋白质含量
食物成分表上食物的蛋白质含量是以每100g食物中的量表示的。这个量没有表达该食物的蛋白质和热能的关系。因为人体的热量需要决定了食物的摄取量。因此,食物作为蛋白质来源的价值也决定于其本身的热值。如我国成年男子从事轻体力劳动时,每日膳食热能供给量为10920kJ,蛋白质供给量为80g。由食物蛋白提供的热能约占总热能的11%。适宜的食物,其中蛋白质提供的热能占总热能的10~15%。因此,将食物中蛋白质用蛋白质的热能占食物总热能的百分数表示(表2-8),可以大体判断该食物作为蛋白质来源的价值。从表2-8看,花生、黄豆、鱼、瘦猪肉都是很好的食物蛋白的来源;如果选择大米作为膳食唯一的食物来源。其蛋白质显然不能满足人体蛋白质的需要量。
表2-8 几种食物的蛋白含量及其热能与食物总热能的比(%)
| 蛋白质 | ||
| g·100g-1食物* | kJ·100kJ-1食物** | |
| 苹果 | 0.3 | 2.8 |
| 稻米(上白梗) | 6.7 | 7.8 |
| 带鱼 | 18.1 | 52.1 |
| 小麦粉(富强粉) | 9.4 | 10.7 |
| 土豆 | 2.3 | 11.9 |
| 花生米 | 26.2 | 19.2 |
| 瘦猪肉 | 16.7 | 20.2 |
| 鸡蛋 | 14.7 | 34.6 |
| 黄豆 | 36.3 | 35. |
| 豆腐(北) | 7.4 | 41.1 |
| 牛肉 | 20.1 | 46. |
*摘自中国医学科学院卫生研究所:食物成分表
**按食物成分表计算得出
2.7.3 膳食蛋白质的质量评价
膳食的蛋白质的营养价值在很大程度上,取决于为机体合成含氮化合物所能提供必需氨基酸的量和模式。所有评定蛋白质质量的方法都是以此概念作为基础的。评价的方法有许多种,但任何一种方法都以一种现象作为评定指标,因而具有一定的局限性,所表示的营养价值也是相对的,因此,具体评价一种食物或混合食物蛋白时,应该根据不同的方法综合考虑。以下叙述几种常用的评价方法。
(1)蛋白质消化率(digestibility,D)食物的蛋白质消化率是指食物蛋白受消化酶水解后吸收的程度,用吸收氮量和总氮量的比值表示:
D=吸收N/摄入N×100
食物蛋白质真实消化率(ture digestibility,TD)可用进食实验测得:
TD=[摄入N-(粪N-粪代谢N)]/摄入N×100
粪氮不全是未消化的食物氮,其中有一部分来自脱落肠粘膜细胞、消化酶和肠道微生物。这部分氮称为粪代谢氮,可在受试者摄食无蛋白膳时,测得粪氮而知,其量约为0.9~1.2g·24h-1。如果粪代谢氮忽略不计,即为表观消化率(apparent digestibility,AD):
AD=(摄入N-粪N)/摄入N×100
表观消化率比真实消化率低,对蛋白质营养价值的估计偏低,因此有较大的安全系数。此外,由于表观消化率的测定方法较为简便,故一般多采用。
用一般烹调方法加工的食物蛋白的消化率为:奶类97~98%、肉类92~94%、蛋类98%、大米82%、土豆74%。植物性食物蛋白由于有纤维包围,比动物性食物蛋白的消化率要低,但纤维素经加工软化破坏或除去后,植物蛋白的消化率可以提高。如大豆蛋白消化率为60%,加工成豆腐后,可提高到90%。
(2)蛋白质的生物价值(biological value,BV)蛋白质的生物价值是为维持和/或生长而在体内保留氮和吸收氮的比值:
BV=[摄入N-(粪N-粪代谢N)-(尿N-尿内源N)]/[摄入N-(粪N-粪代谢N)]×100
蛋白质生物价值受很多因素的影响。对不同食物蛋白的生物价值进行比较时,实验条件应该一致,否则即使同一种食物也会得出不一致的结果。如鸡蛋蛋白的热能占总热能8%时,生物价值为91;占16%时为62。一般情况下,实验动物多采用初断乳的大鼠,饲料中蛋白质含量占10%。几种食物蛋白的生物价值见表2-9。
表2-9 几种食物蛋白的生物价值
| 生物价值 | 生物价值 | 生物价值 | |||
| 大米 | 77 | 土豆 | 67 | 全鸡蛋 | 94 |
| 小麦 | 67 | 大豆 | 64 | 牛肉 | 76 |
| 面粉 | 52 | 蚕豆 | 58 | 猪肉 | 74 |
| 甘薯 | 72 | 花生 | 59 | 虾 | 77 |
| 玉米 | 60 | 白菜 | 76 | 牛奶 | 85 |
(3)蛋白质净利用率(net proteinutilization,NPU)蛋白质生物价值没有考虑在消化过程中未吸收而丢失的氮,所以Miller等建议将生物价值乘以消化率,称之为蛋白质净利用率:
NPU=BV×D=保留N/摄入N
动物的蛋白质净利用率也可用体氮法进行测定。用同窝断乳大鼠分别饲以含维持水平蛋白质的实验饲料(A组)和无蛋白的饲料(B组)各10d。记录各组每日摄食量。实验终了时测定各组动物尸体总氮量和饲料含氮量,按下列计算:
NPU=(BF-BK+IK)/IF
式中: IF=A组N摄入量
BF=A组尸体总N量
BK=B组尸体总N量
IK=B组N摄入量
也可测定实验动物尸体的干重和含水量,利用已知的幼鼠尸体N/H2O的平均比值计算尸体含氮量,则操作更为简便。
(4)蛋白质效力比(protein efficiencyratio,PER)蛋白质效力比是摄入单位重量蛋白质的体重增加数:
PER=体重增加(g)/摄入蛋白质(g)
通常用雄性断乳大鼠为实验对象。Osborne等证明PER随饲料中蛋白质的水平而改变,因而建议在适宜的蛋白质的水平上进行实验。习惯上用含10%蛋白质的饲料,AOAC提出的标准步骤则用含9.09%蛋白质的饲料饲养动物。
此测定最大的缺点是没有把维持所需的蛋白质考虑在内,因而所得结果常不成比例。例如PER为2时,其质量不等于PER为1时的两倍。不同实验测得的PER的重复性往往不佳,为了减少实验室间的变异,假设酪蛋白(参考蛋白)的PER值:
校正的PER=PER×(2.5/酪蛋白的实测PER)
(5)相对蛋白质价值(realative proteinvalue,RPV)相对蛋白质价值是动物摄食受试蛋白的剂量-生长曲线斜率(A)和摄食参考蛋白的剂量-生长曲线斜率(B)比:
RPV=A/B×100
以含3~4种不同剂量的受试食物蛋白喂养断乳大鼠,将大鼠体重增长数(Y)对受试蛋白的进食克数(X)绘制回归方程,求其斜率(A)。同时用含不同剂量的乳白蛋白(参考蛋白)喂养动物,同法得剂量-生长回归方程及斜率(B)。假设前一回归方程为Y1=2.35X1-0.36,后一回归方程为Y2=4.12X2-0.28,则此受试蛋白的相对蛋白质价值可计算如下:
RPV=2.35/4.12×100=57
由受试蛋白测得的回归方程,斜率越大蛋白质利用率越高。
(6)氨基酸评分(amino acid score)或化学评分(chemicalscore) 1946年Block等指出在合成蛋白质的场所,构成蛋白质所必需的氨基酸(AA)必须同时存在,缺乏其中任何一种就会影响合成,因此用食物蛋白氨基酸的组成评价蛋白质。查表计算或测定某种受试食物蛋白或混合食物蛋白中每一种必需氨基酸的含量,与参考蛋白进行比较,以每种氨基酸与参考蛋白氨基酸的比值表示。比值最低的那种氨基酸,即为第一限制氨基酸,此最低比值即受试食物蛋白的氨基酸评分或化学评分。氨基酸评分可计算如下:
氨基酸评分=每克受试蛋白的某种AA含量(mg)/每克参考蛋白的该种AA含量(mg)×100
或 氨基酸评分=受试蛋白每克N的某AA含量(mg)/参考蛋白每克N的该种AA含量(mg)×100
食物蛋白中氨基酸的含量可用比较的参考蛋白的关系表示或用每克氮的关系表示。Block等原用卵蛋白作为与受试蛋白比较的参考蛋白,经后人修改现多采用FAO/WHO(1973)根据学龄前儿童最低需要量制定的理想氨基酸需要量模式(表2-10)与受试蛋白进行比较。
根据理想模式测得的氨基酸评分适用于儿童对食物蛋白利用率的评价;但对成年人则低估了该蛋白质的质量,因为成年人对每克蛋白质氨基酸的需要量较低。
表2-10 理想的氨基酸需要量模式
| 含量(mg·g-1蛋白质) | |
| 异亮氨酸 | 40 |
| 亮氨酸 | 70 |
| 赖氨酸 | 55 |
| 蛋氨酸+胱氨酸 | 35 |
| 苯丙氨酸+酪氨酸 | 60 |
| 苏氨酸 | 40 |
| 色氨酸 | 10 |
| 缬氨酸 | 50 |
表2-11 几种食物蛋白的氨基酸评分
| 蛋白质来源 | 氨基酸含量(mg·g-1蛋白质) | 氨基酸评分(限制氨基酸) | |||
| 赖氨酸 | 含硫氨酸 | 苏氨酸 | 色氨酸 | ||
| 理想模式 | 55 | 35 | 40 | 10 | 100 |
| 稻谷 | 24 | 38 | 30 | 11 | 44(赖氨酸) |
| 豆 | 72 | 24 | 42 | 14 | 68(含硫氨酸) |
| 奶粉 | 80 | 29 | 37 | 13 | 83(含硫氨酸) |
| 谷、豆、奶粉混合(67:22:11) | 51 | 32 | 35 | 12 | 88(苏氨酸) |
*根据Pellett,Pl etal(1978):“Nutritional Evaluation of Protein Foods”计算
2.7.4 蛋白质的互补作用
几种食物混食,由于必需氨基酸的种类和数量互相补充,而能更接近人体需要量的比值,使生物价值得到相应的提高,这种现象称为蛋白质的互补作用。如小麦、小米、牛肉、大豆各个单独食用时,其蛋白质生物价值分别为67、57、69、64,而混食的生物价值可高达89。中美洲和巴拿马营养研究所(INCAP)制成一种植物混合食物,称为“Incaparina”,其中含玉米粉29%、高梁29%、棉籽粉38%、啤酒酵母3%、碳酸钙1%及维生素A。这种混合食物是营养不良地区低蛋白膳食的良好补助食物,其蛋白质的生物价值仅略次于牛乳蛋白。
用限制氨基酸补充到相应的食物中,如用赖氨酸补充谷类蛋白,用蛋氨酸、赖氨酸和苏氨酸补充花生粉,同样可以起到互补作用。如在面粉中添加赖氨酸0.2%,面粉蛋白的生物价值可由47提高到71,学龄儿童食用这种赖氨酸强化食品一年后,身高、体重和抵抗力等均较对照组有显著提高。
因为组成蛋白质氨基酸必须同时存在才能合成蛋白质,而且机体内氨基酸的储存量很少,因此膳食中不同蛋白质必须在同一餐摄入才能起到互补作用。如每3h单独以一种必需氨基酸饲养大鼠,氨酸的利用不佳,大鼠不能生长。
2.7.5 加工对食物蛋白营养价值的影响
食物加工的方法有加热、冷冻、搅拌、高压、盐腌等,其中以加热对蛋白质的影响最大。蛋白质经过加热处理,构型(Configuration)改变,固有的生物活性丧失,这种变化称为变性。如蛋清受热凝固、瘦肉受热收缩变硬都是变性现象。各种蛋白质的耐热性能不一,多数在60~80℃开始变性。变性不同于变质,蛋白质的一级结构未变。
烹调和防止食物腐败往往采用100~200℃的加热法。在上述温度下和没有糖存在时,蛋白质发生变性,维持蛋白质空间构象(Conformation)的次级键发生断裂,破坏了肽键原有的空间排列。原来在分子内部的一些非极性基团暴露到分子表面,使蛋白质的溶解度降低,甚至凝固。同时各种反应基团如-NH2、-COOH、-OH、-SH释放出来,使蛋白质易于酶解,也变得容易消化。食物中氨基酸的损失不大。
某些食物中含有阻碍酶作用的抑制剂。如大豆中的抗胰蛋白酶、血球凝集素,蛋清中的卵粘蛋白等受热后因变性而失去活性。解除了对酶的抑制作用,从而提高了食物的营养价值。
大部分食品除蛋白质外,还含有具还原性的糖类。蛋白质过度加热,尤其在有还原糖存在的条件下,可产生非酶的美拉德(Maillard)反应。食物变成棕褐色,其中氨基酸主要是赖氨酸遭到破坏,减低了蛋白质的生物价值。同时蛋白质的酶解也下降,使食物不易消化。美拉德反应的过程甚为复杂,即使在较低温度下也能进行,只是反应速率相当缓慢。
参考文献
1.Munro HN andCrim MC:In“Modern Nutrition in Health and Disease”,Goodhart RS Ed.pp51~98,1980
2.王成发:营养学报3(4):185,1981
3.陈学存等:第三届全国营养学术会议论文摘要汇编,1页,1981
4.曲绵域等:实用运动医学(修订版),人民体育出版社,152页,1982年
5.Grant TP etal:Surg Clin N Amer 61(3):437~464,1981
6.SmelserDN:AmJ Clin Nutr35(2):342,1982