第四节 心血管活动的调节
人体在不同的生理状况下,各器官组织的代谢水平不同,对血流量的需要也不同。机体的神经和体液机制可对心脏和各部分血管的活动进行调节,从而适应各器官组织在不同情况下对血流量的需要,协调地进行各器官之间的血流分配。
一、神经调节
心肌和血管平滑肌接受自主神经支配。机体对心血管活动的神经调节是通过各种心血管反射实现的。
(一)心脏和血管的神经支配
1.心脏的神经支配支配心脏的传出神经为心交感神经和心迷走神经。
(1)心交感神经及其作用:心交感神经的节前神经元位于脊髓第1-5胸段的中间外侧柱,其轴突末梢释放的递质为乙酰胆碱,后者能激活节后神经元膜上的N型胆碱能受体。心交感节后神经元位于星状神经节或颈交感神经节内。节后神经元的轴突组织心脏神经丛,支配心脏各个部分,包括窦房结、房室交界、房室束、心房肌和心室肌。
在动物实验中看到,两侧心交感神经对心脏的支配有所差别。支配窦房结的交感纤维主要来自右侧心交感神经,支配房室交界的交感主要来自左侧心交感神经。在功能上,右侧心交感神经兴奋时以引起心率加快的效应为主,而左侧心交感神经兴奋则以加强心肌收缩能力的效应为主。
心交感节后神经元末梢释放的递质为去甲肾上腺素,与心肌细胞膜上的β型肾上腺素能受体结合,可导致心率加快,房室交界的传导加快,心房肌和心室肌的收缩能力加强。这些效应分别称为正性变时作用、正性变传导作用和正性变力作用。刺激心交感神经可使心缩期缩短,收缩期室内压上升的速率加大;室内压峰值增高,心舒早期室内压下降的速率加大。这些变化还有利于心室在舒张期的充盈。交感神经末梢释放的去甲肾上腺素和循环血液中的儿茶酚胺都能作用于心肌细胞膜的β肾上腺素能受体,从而激活腺苷酸环化酶,使细胞内cAMP的浓度升高,继而激活蛋白激酶和细胞内蛋白质的磷酸化过程,使心肌膜上的钙通道激活,故在心肌动作电位平台期Ca2+的内流增加,细胞内肌浆网释放的Ca2+也增加,其最终效应是心肌收缩能力增强,每搏作功增加。交感神经兴奋引起的正性变传导作用可使心室各部分肌纤维的收缩更趋同步化,这也有利于心肌收缩力的加强。
心交感神经对心肌的效应,主要是通过β肾上腺素能受体实现的。但心肌也有α肾上腺素能受体。激活心肌的α肾上腺素能受体主要引起正性变力效应,而心率的变化则不显著;另外,室内压上升和下降的速率并无明显加快,故心肌的收缩期延长。心肌α肾上腺素能受体的生理功能还不很清楚,有人认为,当β肾上腺素能受体功能受损时(例如长期使用β肾上腺素能受体拮抗剂),心肌α肾上腺素能受体可继续对交感神经和儿茶酚胺发生反应。在病理情况下,心肌α肾上腺素能受体可能在心肌缺血后再灌注引起的心律失常中起一定的作用。
(2)心迷走神经及其作用:支配心脏的副交感神经节前纤维行走于神经干中。这些节前神经元的细胞体位于延髓的迷走神经背核和疑核,在不同的动物中有种间差异。在胸腔内,心迷走神经纤维和心交感神经一起组成心脏神经丛,并和交感纤维伴行进入心脏,与心内神经节细胞发生突触联系。心迷走神经的节前和节后神经元都是胆碱能神经元。节后神经纤维支配窦房结、心房肌、房室交界、房室速及其分支。心室肌也有迷走神经支配,但纤维末梢的数量远较心房肌中为少。两侧心迷走神经对心脏的支配也有差别,但不如两侧心交感神经支配的差别显著。右侧迷走神经对窦房结的影响占优势;左侧迷走神经对房室交界的作用占优势。
心迷走神经节后纤维末梢释放的乙酰胆碱作用于心肌细胞膜的M型胆碱能受体,可导致心率减慢,心房肌收缩能力减弱,心房肌不应期缩短,房室传导速度减慢,即具有负性变时、变力和变传导作用。刺激迷走神经时也能使心室肌收缩减弱,但其效应不如心房肌明显。迷走神经减弱心肌收缩能力的机制是由于其末梢释放的乙酰胆碱作用于M胆碱能受体后,可使腺苷酸环化酶抑制,因此细胞内cAMP浓度降低,肌浆网释放Ca2+减少(参见本章第二节)。
一般说来,心迷走神经和心交感神经对心脏的作用是相对抗的。但是当两者同时对心脏发生作用时,其总的效应并不等于两者分别作用时发生效应的代数和。在多数情况下,心迷走神经的作用比交感神经的作用占有较大的优势。在动物实验中如同时刺激迷走神经和心交感神经,常出现心率减慢效应。其机制比较复杂。此外,在交感神经末梢上有接头前M型胆碱能受体,在迷走神经末梢上有接头前α肾上腺素能受体。迷走神经末梢释放的乙酰胆碱可作用于交感神经末梢的M型胆碱能受体,使交感神经末梢释放递质减少;交感神经末梢释放的去甲肾上腺素也可作用于迷走神经末梢的α肾上腺素能受体,使迷走神经末梢释放递质减少。这种通过接头前受体影响神经末梢递质释放的过程称为递质释放的接头前(或突触前)调制。
(3)支配心脏的肽能神经元:用免疫细胞化学方法证明,心脏中存在多种神经纤维,如神经肽Y、血管活性肠肽、降钙素基因相关肽、阿片肽等。现已知一些肽类递质可与其它递质,如单胺和乙酰胆碱,共存于同一神经元内,并共同释放。目前对于分布在心脏的肽神经元的生理功能还不完全清楚,但心脏内肽能神经纤维的存在说明这些肽类递质也可能参与对心肌和冠状血管作用,降钙素基因相关肽有加快心率的作用等。
2.血管的神经支配除真毛细血管外,血管壁都有平滑肌分布。不同血管的平滑肌的生理特性有所不同,有些血管平滑肌有自发的肌源性活动,而另一些血管平滑肌很少有肌源性活动。但绝大多数血管平滑肌都受局部组织代谢产物影响。支配血管平滑肌的神经纤维可分为缩血管神经纤维和舒血管神经纤维两大类,两者又统称为血管运动神经纤维。
(1)缩血管神经纤维:缩血管神经纤维都是交感神经纤维,故一般称为并感缩血管纤维,其节前神经元位于脊髓胸、腰段的中间外侧柱内,末梢释放的递质为乙酰胆碱。节后神经元位于椎旁和椎前神经节内,末梢释放的递质为去甲肾上腺素。血管平滑肌细胞有α和β两类肾上腺素能受体。去甲肾上腺素与α肾上腺素能受体结合,可导致血管平滑肌收缩;与β肾上腺素能受体结合,则导致血管平滑肌舒张。去甲肾上腺素与α肾上腺素能受体结合的能力较与β受体结合的能力强,故缩血管纤维兴奋时引起缩血管效应。
体内几乎所有的血管都受交感缩血管纤维支配,但不同部位的血管中缩血管纤维分布的密度不同。皮肤血管中缩血管纤维分布最密,骨骼肌和内脏的血管次之,冠状血管和脑血管中分布较少。在同一器官中,动脉中缩血管纤维的密度高于静脉,微动脉中密度最高,但毛细血管前括约肌中神经纤维分布很少。
人体内多数血管只接受交感缩血管纤维的单一神经支配。在安静状态下,并感缩血管纤维持续发放约1-3次/秒的低频冲动,称为交感缩血管紧张,这种紧张性活动使血管平滑肌保持一定程度的收缩状态。当交感缩血管紧张增强时,血管平滑肌进一步收缩;交感缩血管紧张减弱时,血管平滑肌收缩程度减低,血管舒张。在不同的生理状况下,交感缩血管纤维的放电频率在每秒低于1次至每秒8-10次的范围内变动。这一变动范围足以使血管口径在很大范围内发生变化,从而调节不同器官的血流阻力和血流量。当支配某一器官血管床的并感缩血管纤维兴奋时,可引起该器官血管床的血流阻力增高,血流量减少;同时该器官毛细血管前阻力和毛细血管后阻力的比值增大,使毛细血管血压降低,组织液的生成减少而有利于重吸收;此外,该器官血管床的容量血管收缩,器官内的血容量减少。
近年来,用免疫细胞化学等方法证明,缩血管纤维中有神经肽Y与去甲肾上腺素共存,神经兴奋时两者可共同释放。神经肽Y具有极强烈的缩血管效应。
(2)舒血管神经纤维;体内有一部分血管除接受缩血管纤维支配外,还接受舒血管纤维支配。舒血管神经纤维主要有以下几种:
1)交感舒血管神经纤维:有些动物如狗和猫,支配骨骼肌微动脉的交感神经中除有缩血管纤维外,还有舒血管纤维。交感舒血管纤维末梢释放的递质为乙酰胆碱,阿托品可阻断其效应。交感舒血管纤维在平时没有紧张性活动,只有在动物处于情绪激动状态和发生防御反应时才发放冲动,使骨骼肌血管舒张,血流量增多。在人体内可能也有交感舒血管纤维存在。
2)副交感舒血管神经纤维:少数器官如脑膜、唾液腺、胃肠外分泌腺和外生殖器等,其血管平滑肌除接受交感缩血管纤维支配外,还接受副交感舒血管纤维支配。例如面神经中有支配软脑膜血管的副交感纤维,迷走神经中有支配肝血管的副交感纤维,盆神经中有支配盆腔器官和外生殖器血管的副交感纤维等等。副交感舒血管纤维末梢释放的递质为乙酰胆碱,后者与血管平滑肌的M型胆碱能受体结合,引起血管舒张。副交感舒血管纤维的活动只对器官组织局部血流起调节作用,对循环系统总的外周阻力的影响很小。
3)脊髓背根舒血管纤维:皮肤伤害性感觉传入纤维在外周末梢可发生分支。当皮肤受到伤害性刺激时,感觉冲动一方面沿传入纤维向中枢传导,另一方面可在末梢分叉处沿其它分支到达受刺激部位邻近的微动脉,使微动脉舒张,局部皮肤出现红晕。这种仅通过轴突外周部位完成的反应,称为轴突反射。这种神经纤维也称背根舒血管纤维,其释放的递质还不很清楚,有人认为是P物质,也有人认为可能是组胺或ATP。近年来用免疫细胞化学方法证明,脊神经节感觉神经元中有降钙素基因相关肽与P物质共存;另外,在许多血管周围常可看到有降钙素基因相关肽神经纤维分布。降钙素基因相关肽有强烈的舒血管效应,故有人认为这种多肽可能是引起轴突反射舒血管效应的递质。
4)血管活性肠肽神经元:有些自主神经元内有血管活性肠肽和乙酰胆碱共存,例如支配汗腺的交感神经元和支配颌下腺的副交感神经元等。这些神经元兴奋时,其末稍一方面释放乙酰胆碱,引起腺细胞分泌;另一方面释放血管活性肠肽,引起舒血管效应,使局部组织血流增加。
(二)心血管中枢
神经系统对心血管活动的调节是通过各种神经反射来实现的。在生理学中将与控制心血管活动有关的神经元集中的部位称为心血管中枢。控制心血管活动的神经元并不是只集中在中枢神经系统的一个部位,而是分布在中枢神经系统从脊髓到大脑皮层的各个水平上,它们各具不同的功能,又互相密切联系,使整个心血管系统的活动协调一致,并与整个机体的活动相适应。
1.延髓心血管中枢一般认为,最基本的心血管中枢位于延髓。这一概念最早是在19世纪70年代提出的。它基于以下的动物实验结果:在延髓上缘横断脑干后,动物的血压并无明显的变化,刺激坐骨神经引起的升血压反射也仍存在;但如果将横断水平逐步移向脑干尾端,则动脉血压就逐渐降低,刺激坐骨神经引起的升血压反射效应也逐渐减弱。当横断水平下移至延髓闩部时,血压降低至大约5.3kPa(40mmHg)。这些结果说明,心血管的正常的紧张性活动不是起源于脊髓,而是起源于延髓,因为只要保留延髓及其以下中枢部分的完整,就可以维持心血管正常的紧张性活动,并完成一定的心血管反射活动。
延髓心血管中枢的神经元是指位于延髓内的心迷走神经元和控制心交感神经和交感缩血管神经活动的神经元。这些神经元在平时都有紧张性活动,分别称为心迷走紧张、心交感紧张和交感缩血管紧张。在机体处于安静状态时,这些延髓神经元的紧张性活动表现为心迷走神经纤维和交感神经纤维持续的低频放电活动。
一般认为,延髓心血管中枢至少可包括以下四个部位的神经元:
(1)缩血管区:引起交感缩血管神经正常的紧张性活动的延髓心血管神经元的细胞体位于延髓头端的腹外侧部,称为C1区。这些神经元内含有肾上腺素,它们的轴突下行到脊髓的中间外侧柱。心交感紧张也起源于此区神经元。
(2)舒血管区:位于延髓尾端腹外侧部A1区(即在C1区的尾端)的去甲肾上腺素神经元,在兴奋时可抑制C1区神经元的活动,导致交感缩血管紧张降低,血管舒张。
(3)传入神经接替站:延髓孤束核的神经元接受由颈动脉窦、主动脉弓和心脏感受器经舌咽神经和迷走神经传入的信息,然后发出纤维至延髓和中枢神经系统其它部位的神经元,继而影响心血管活动。
(4)心抑制区:心迷走神经元的细胞体位于延髓的迷走神经背核和疑核。
2.延髓以上的心血管中枢在延髓以上的脑干部分以及大脑和小脑中,也都存在与心血管活动有关的神经元。它们在心血管活动调节中所起的作用较延髓心血管中枢更加高级,特别是表现为对心血管活动和机体其它功能之间的复杂的整合。例如下丘脑是一个非常重要的整合部位,在体温调节、摄食、水平衡以及发怒、恐惧等情绪反应的整合中,都起着重要的作用。这些反应都包含有相应的心血管活动的变化。在动物实验中可以看到,电刺激下丘脑的一些区域,可以引起躯体肌肉以及心血管、呼吸和其它内脏活动的复杂的变化。这些变化往往是通过精细整合的,在生理功能上往往是相互协调的。例如电刺激下丘脑的“防御反应区”,可立即引起动物的警觉状态,骨骼肌肌紧张加强,表现出准备防御的姿势等行为反应,同时出现一系列心血管活动的改变,主要是心率加快,心搏加强,心输出量增加,皮肤和内脏血管收缩,骨骼肌血管舒张,血压稍有升高。这些心血管反应显然是与当时机体所处的状态相协调的,主要是使骨骼肌有充足的血液供应,以适应防御、搏斗或逃跑等行为的需要。
大脑的一些部位,特别是边缘系统的结构,如颞极、额叶的眶面、扣带回的前部、杏仁、隔、海马等,能影响下丘脑和脑干其它部位的心血管神经元的活动,并和机体各种行为的改变相协调。大脑新皮层的运动区兴奋时,除引起相应的骨骼肌收缩外,还能引起该骨骼肌的血管舒张。刺激小脑的一些部位也可引起心血管活动的反应。例如刺激小脑顶核可引起血压升高,心率加快。顶核的这种效应可能与姿势和体位改变时伴随的心血管活动变化有关。
(三)心血管反射
当机体处于不同的生理状态如变换姿势、运动、睡眠时,或当机体内、外环境发生变化时,可引起各种心血管反射,使心输出量和各器官的血管收缩状况发生相应的改变,动脉血压也可发生变动。心血管反射一般都能很快完成,其生理意义在于使循环功能能适应于当时机体所处的状态或环境的变化。
1.颈动脉窦和主动脉弓压力感觉反射当动脉血压升高时,可引起压力感受性反射,其反射效应是使心率减慢,外周血管阻力降低,血压回降。因此这一反射曾被称为降压反射。
(1)动脉压力感觉器:压力感受性反射的感受装置是位于颈动脉窦和主动脉弓血管外膜下的感觉神经末梢,称为动脉压力感受器(图4-25)。动脉压力感觉器并不是直接感觉血压的变化,而是感觉血管壁的机械牵张程度。当动脉血压升高时,动脉管壁被牵张的的程度就升高,压力感觉器发放的神经冲动也就增多。在一定范围内,压力感觉器的传入冲动频率与动脉管壁扩张程度成正比。由图4-26可见,在一个心动周期内,随着动脉血压的波动,窦神经的传入冲动频率也发生相应的变化。
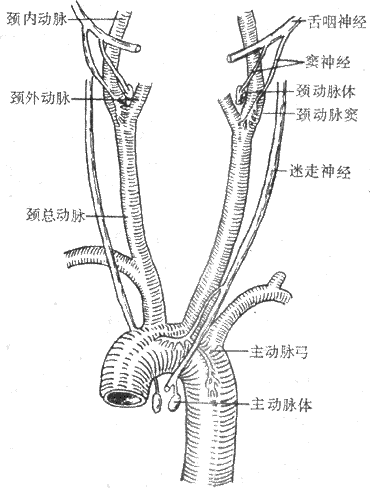
图4-25颈动脉窦区与主动脉弓区的压力感受器与化学感受器
(2)传入神经和中枢联系:颈动脉窦压力感受器的传入神经纤维组成颈动脉窦神经。窦神经加入舌咽神经,进入延髓,和孤束核的神经元发生突触联系。主动脉弓压力感受器的传入神经纤维行走于迷走神经干内,然后进入延髓,到达孤束核。兔的主动脉弓压力感受器传入纤维自成一束,与迷走神经伴行,称为主动脉神经。
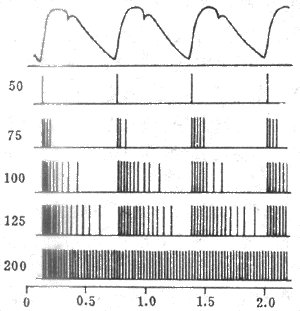
图4-26单根窦神经压力感受器传入纤维在不同动脉压时的放电图
中最上方为主动脉血压波,左侧的数字为主动脉平均压(mmHg,1mmHg=0.133kPa)
压力感受器的传入神经冲动到达孤束核后,可通过延髓内的神经通路使延髓端腹外侧部C1区的血管运动神经元抑制从而使交感神经紧张性活动减弱;孤束核神经元还与延髓内其它神经核团以及脑干其它部位如脑桥、下丘脑等的一些神经核团发生联系,其效应也是使交感神经紧张性活动减弱。另外,压力感受器的传入冲动到达孤束核后还与迷走神经背核和疑核发生联系,使迷走神经的活动加强。
(3)反射效应:动脉血压升高时,压力感受器传入冲动增多,通过中枢机制,使心迷走紧张加强,心交感紧张和交感缩血管紧张减弱,其效应为心率减慢,心输出量减少,外周血管阻力降低,故动脉血压下降。反之,当动脉血压降低时,压力感受器传入冲动减少,使迷走紧张减弱,交感紧张加强,于是心率加快,心输出量增加,外周血管阻力增高,血压回升。
在动物实验中可将颈动脉窦区和循环系统其余部分隔离开来,但仍保留它通过窦神经与中枢的联系。在这样的制备中,人为地改变颈动脉窦区的灌注压,就可以引起体循环动脉压的变化,并画出压力感受性反射功能曲线(见图4-27)。由图可见,压力感受性反射功能曲线的中间部分较陡,向两端渐趋平坦。这说明当窦内压在正常平均动脉压水平(大约13.3kPa或100mmHg)的范围内发生变动时,压力感受性反射最为敏感,纠正偏离正常水平的血压的能力最强,动脉血压偏离正常水平愈远,压力感受性反射纠正异常血压的能力愈低。
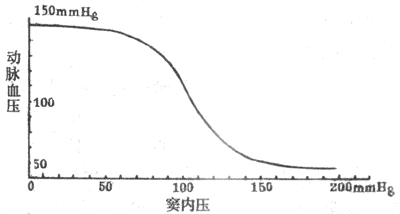
图4-27 在实验中测得的颈动脉窦内压力与动脉血压的关系(1mmHg=0.133kPa)
(4)压力感受性反射的生理意义:压力感受性反射在心输出量、外周血管阻力、血量等发生突然变化的情况下,对动脉血压进行快速调节的过程中起重要的作用,使动脉血压不致发生过分的波动,因此在生理学中将动脉压力感受器的传入神经称为缓冲神经。在动物实验中可看到,正常狗24小时内动脉血压的变化范围一般在平均动脉压(约13.3kPa或100mmHg)约1.3-2.0kPa(10-15mmHg)以内;而在切除两侧缓冲神经的狗,血压经常出现很大的波动,其变动范围可超过平均动脉压上下各6.7kPa(50mmHg)。但是,在切除缓冲神经的动物,一天中血压的平均值并不明显高于正常,因此认为压力感受性反射在动脉血压的长期调节中并不起重要作用。在慢性高血压患者或实验性高血压动物中,压力感受性反射功能曲线向右移位。这种现象称为压力感受性反射的重调定(resetting),表示在高血压的情况下压力感受性反射的工作范围发生改变,即在较正常高的血压水平上进行工作,故动脉血压维持在比较高的水平。压力感受性反射重调定的机制比较复杂。重调定可发生在感受器的水平,也可发生在反射的中枢部分。
2.心肺感受器引起的心血管反射在心房、心室和肺循环大血管壁存在许多感受器,总称为心肺感受器,其传入神经纤维行走于迷走神经干内。引起心肺感受器兴奋的适宜刺激有两大类。一类是血管壁的机械牵张。当心房、心室或肺循环大血管中压力升高或血容量增多而使心脏或血管壁受到牵张时,这些机械或压力感受器就发生兴奋。和颈动脉窦、主动脉弓压力感受器相比较,心肺感受器位于循环系统压力较低的部分,故常称之为低压力感受器,而动脉压力感受器则称为高压力感受器。在生理情况下,心房壁的牵张主要是由血容量增多而引起的,因此心房壁的牵张感受器也称为容量感受器。另一类心肺感受器的适宜刺激是一些化学物质,如前列腺素、缓激肽等。有些约物如藜芦碱等也能刺激心肺感受器。
大多数心肺感受器受刺激时引起的反射效应是交感紧张降低,心迷走紧张加强,导致心率减慢,心输出量减少,外周血管阻力降低,故血压下降。在多种实验动物中,心肺感受器兴奋时肾交感神经活动的抑制特别明显,使肾血流量增加,肾排水和排钠量增多。这表明心肺感受器引起的反射在血量及体液的量和成分的调节中有重要的生理意义。心肺感受器引起的反射的传出途径除神经外还有体液的成分。心肺感受器的传入冲动可抑制血管升压素的释放。血管升压素的减少导致肾排水增多(见后)。
3.颈动脉体和主动脉体化学感受性反射在颈总动脉分叉处和主动脉弓区域,存在一些特殊的感受装置,当血液的某些化学成分发生变化时,如缺氧、CO2分压过高、H+浓度过高等,可以刺激这些感受装置。因此这些感受装置被称为颈动脉体和主动脉体化学感受器。这些化学感受器受到刺激后,其感觉信号分别由颈动脉窦神经和迷走神经传入至延髓孤束核,然后使延髓内呼吸神经元和心血管活动神经元的活动发生改变。
化学感受性反射的效应主要是呼吸加深加快(详见第五章)。在动物实验中人为地维持呼吸频率和深度不变,则化学感受器传入冲动对心血管活动的直接效应是心率减慢,心输出量减少,冠状动脉舒张,骨骼肌和内脏血管收缩。由于外周血管阻力增大的作用超过心输出量减少的作用,故血压升高。在动物保持自然呼吸的情况下,化学感受器受刺激时引起的呼吸加深加快,心输出量增加,外周血管阻力增大,血压升高。
化学感受性反射在平时对心血管活动并不起明显的调节作用。只有在低氧、窒息、失血、动脉血压过低和酸中毒情况下才发生作用。
4.躯体感受器引起的心血管反射刺激躯体传入神经时可以引起各种心血管反射。反射的效应取决于感受器的性质、刺激的强度和频率等因素。用低至中等强度的低频电脉冲刺激骨骼肌传入神经,常可引起降血压效应;而用高强度高频率电刺激皮肤传入神经,则常引起升血压效应。在平时,肌肉活动,皮肤冷、热刺激以及各种伤害性刺激都能引起心血管反射活动。中医针刺治疗某些心血管疾病的生理基础,就在于激活肌肉或皮肤的一些感受器传入活动,通过中枢神经系统内复杂的机制,使异常的心血管活动得到调整。
5.其它内脏感受器引起的心血管反射扩张肺、胃、肠、膀胱等空腔器官,挤压睾丸等,常可引起心率减慢和外周血管舒张等效应。这些内脏感受器的传入神经纤维行走于迷走神经或交感神经内。
6.脑缺血反应当脑血流量减少时,心血管中枢的神经元可对脑缺血发生反应,引起交感缩血管紧张显著加强,外周血管高度收缩,动脉血压升高,称为脑缺血反应。
(四)心血管反射的中枢整合型式
在过去较长的时期中,生理学的一个概念是认为整个交感神经系统或者一起兴奋,或者一起抑制。但后来认识到,不同部分的交感神经、副交感神经的活动都是有分化的。具体地说,对于某种特定的刺激,不同部分的交感神经的反应方式和程度是不同的,即表现为一定整合型式的反应,使各器官之间的血流分配能适应机体当时功能活动的需要。例如当动物的安全受到威胁而处于警觉、戒备状态时,可出现一系列复杂的行为和心血管反应,称为防御反应。猫的防御反应表现为瞳孔扩大、竖毛、耳廓平展、弓背、伸爪、呼吸加深、怒叫,最后发展为搏斗或逃跑;伴随防御反应的心血管整合型式,最特征性的是骨骼肌血管舒张,同时心率加快,心输出量增加,内脏和皮肤血管收缩,血压轻度升高。人在情绪激动时也可发生这一整套心血管反应整合型式。肌肉运动时心血管活动的整合型式与防御反应相似,但血管舒张仅发生在进行运动的肌肉,不进行运动的肌肉的血管发生收缩。睡眠时心脏和血管的活动恰好与防御反应时相反,即心率减慢,心输出量稍减少,内脏血管舒张,骨骼肌血管收缩,血压稍降低。
二、体液调节
心血管活动的体液调节是指血液和组织液中一些化学物质对心肌和血管平滑肌的活动发生影响,从而起调节作用。这些体液因素中,有些是通过血液携带的,可广泛作用于心血管系统;有些则在组织中形成,主要作用于局部的血管,对局部组织的血流起调节作用。
(一)肾素-血管紧张素系统
肾素是由肾近球细胞合成和分泌的一种酸性蛋白酶,经肾静脉进入血循环。血浆中的肾素底物,即血管紧张素原,在肾素的作用下水解,产生一个十肽,为血管紧张素I。在血浆和组织中,特别是在肺循环血管内皮表面,存在有血管紧张素转换酶,在后者的作用下,血管紧张素I水解,产生一个八肽,为血管紧张素Ⅱ。血管紧张素Ⅱ在血浆和组织中的血管紧张素酶A的作用下,再失去一个氨基酸,成为七肽血管紧张素Ⅲ。上述过程可由图4-28表示。血管紧张素Ⅱ和血管紧张素Ⅲ作用于血管平滑肌和肾上腺皮质等细胞的血管紧张素受体,引起相应的生理效应。
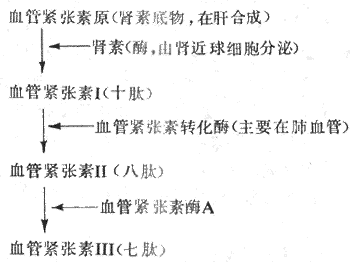
当各种原因引起肾血流灌注减少时,肾素分泌就会增多。血浆中Na+浓度降低时,肾素分泌也增加。肾素分泌受神经和体液机制的调节,详见第八章。
对体内多数组织、细胞来说,血管紧张素I不具有活性。血管紧张素中最重要的是血管紧张素Ⅱ。血管紧张素Ⅱ可直接使全身微动脉收缩,血压升高;也可使静脉收缩,回心血量增多。血管紧张素Ⅱ可作用于交感缩血管纤维末梢上的接头前血管紧张素受体,起接头前调制的作用,使交感神经末梢释放递质增多。血管紧张素Ⅱ还可作用于中枢神经系统内一些神经元的血管紧张素受体,使交感缩血管紧张加强。因此,血管紧张素Ⅱ可以通过中枢和外周机制,使外周血管阻力增大,血压升高。此外,血管紧张素Ⅱ可强烈刺激肾上腺皮质球状带细胞合成和释放醛固酮,后者可促进肾小管对Na+的重吸收,并使细胞外液量增加。血管紧张素Ⅱ还可引起或增强渴觉,并导致饮水行为。血管紧张素Ⅲ的缩血管效应仅为血管紧张素Ⅱ的10%-20%,但刺激肾上腺皮质合成和释放醛固酮的作用较强。
在某些病理情况下,如失血时,肾素-血管紧张素系统的活动加强,并对循环功能的调节起重要作用。
(二)肾上腺素和去甲肾上腺素
肾上腺素和去甲肾上腺素在化学结构上都属于儿茶酚胺。循环血液中的肾上腺素和去甲肾上腺素主要来自肾上腺髓质的分泌。肾上腺素能神经末梢释放的递质去甲肾上腺素也有一小部分进入血液循环。肾上腺髓质释放的儿茶酚胺中,肾上腺素约占80%,去甲肾上腺素约占20%。
血液中的肾上腺素和去甲肾上腺素对心脏和血管的作用有许多共同点,但并不完全相同,因为两者对不同的肾上腺素能受体的结合能力不同。肾上腺素可与α和β两类肾上腺素能受体结合。在心脏,肾上腺素与β肾上腺素能受体结合,产生正性变时和变力作用,使心输出量增加。在血管,肾上腺素的作用取决于血管平滑肌上α和β肾上腺素能受体分布的情况。在皮肤、肾、胃肠、血管平滑肌上α肾上腺素能受体在数量上占优势,肾上腺素的作用是使这些器官的血管收缩;在骨骼肌和肝的血管,β肾上腺素能受体占优势,小剂量的肾上腺素常以兴奋β肾上腺素能受体的效应为主,引起血管舒张,大剂量时也兴奋α肾上腺素能受体,引起血管收缩。去甲肾上腺素主要与α肾上腺素能受体结合,也可与心肌的β1肾上腺素能受体结合,但和血管平滑肌的β2肾上腺素能受体结合的能力较弱。静脉注射去甲肾上腺素,可使全身血管广泛收缩,动脉血压升高;血压升高又使压力感受性反射活动加强,压力感受性反射对心脏的效应超过去甲肾上腺素对心脏的直接效应,故心率减慢。
(三)血管升压素
血管升压素是下丘脑视上核和室旁核一部分神经元内合成的。这些神经元的轴突行走在下丘脑垂体束中并进入垂体后叶,其末梢释放的血管升压素作为垂体后叶激素进入血循环。血管升压素的合成和释放过程也称为神经分泌。
血管升压素在肾集合管可促进水的重吸收,故又称为抗利尿激素(见第八章)。血管升压素作用于血管平滑肌的相应受体,引起血管平滑肌收缩,是已知的最强的缩血管物质之一。在正常情况下,血浆中血管升压素浓度升高时首先出现抗利尿效应;只有当其血浆浓度明显高于正常时,才引起血压升高。这是因为血管升压素能提高压力感受性反射的敏感性,故能缓冲升血压效应。血管升压素对体内细胞外液量的调节起重要作用。在禁水、失水、失血等情况下,血管升压素释放增加,不仅对保留体内液体量,而且对维持动脉血压,都起重要的作用。
(四)血管内皮生成的血管活性物质
多年来一直以为血管内皮只是衬在心脏和血管腔面的一层单层细胞组织;在毛细血管处,通过内皮进行血管内外的物质交换。近年已证实,内皮细胞可以生成并释放若干种血管活性物质,引起血管平滑肌舒张或收缩。
1.血管内皮生成的舒血管物质血管内皮生成和释放的舒血管物质有多种。内皮细胞内的前列环素合成酶可以合成前列环素(也称前列腺素I2,即PGI2)。血管内的搏动性血流对内皮产生的切应力可使内皮释放PGI2,后者使血管舒张。
现在认为,内皮生成的另一类舒血管物质更重要,即内皮舒张因子(endothelium-derivedrelaxing factor, EDRF)。EDRF的化学结构尚未完全弄清,但多数人认为可能是一氧化氮(NO),其前体是L-精氨酸。EDRF可使血管平滑肌内的鸟苷酸环化酶激活,cGMP浓度升高,游离Ca2+浓度降低,故血管舒张。血流对血管内皮产生的切应力可引起EDRF的释放。低氧也可使内皮释放EDRF。此外,内皮细胞表面存在着一些受体,例如P物质受体、5-羟色胺受体、ATP受体、M型胆碱能受体等,这些受体被相应的物质激活后,可释放EDRF。有些缩血管物质,如去甲肾上腺素、血管升压素、血管紧张素Ⅱ等,也可使内皮释放EDRF,后者可减弱缩血管物质对血管平滑肌的直接收缩效应。在离体实验中可看到,将乙酰胆碱作用于内皮完整的血管,引起血管舒张;而将血管内皮去除后,乙酰胆碱则使血管收缩。
2.血管内皮生成的缩血管物质血管内皮细胞也可产生多种缩血管物质,称为内皮缩血因子(endothelum-derived vasoconstrictor factor,EDCF)。近年来研究得较深入的是内皮素。内皮素(endothelin)是内皮细胞合成和释放的由21个氨基酸构成的多肽,是已知的最强烈的缩血管物质之一。给动物注射内皮素可引起持续时间较长的升血压效应。但在升血压之前常先出现一个短暂的降血压过程。有人解释,内皮素也可引起EDRF的释放,故有一短暂的降血压反应。在生理情况下,血管内血流对内皮产生的切应力可使内皮细胞合成和释放内皮素。
(五)激肽释放酶-激肽系统
激肽释放酶是体内的一类蛋白酶,可使某些蛋白质底物激肽原分解为激肽。激肽具有舒血管活性,可参与对血压和局部组织血流的调节。
激肽释放酶可分为两大类,一类存在于血浆,称为血浆激肽释放酶;另一类存在于肾、唾液腺、胰腺等器官组织内,称为腺体激肽释放酶或组织激肽释放酶。激肽原是存在于血浆中的一些蛋白质,分为高分子量激肽原和低分子量激肽原。在血浆中,血浆激肽释放酶作用于高分子量激肽原,使之水解,产生一种九肽,即缓激肽。在肾、唾液腺、胰腺、汗腺以及胃肠粘膜等组织中,腺体激肽释放酶作用于血浆中的低分子量激肽原,产生一种十肽,为赖氨酰缓激肽,也称胰激肽或血管舒张素。后者在氨基肽酶的作用下失去赖氨酸,成为缓激肽。缓激肽在激肽酶的作用下水解失活。
激肽可使血管平滑肌舒张和毛细血管通透性增高;但对其它的平滑肌则引起收缩。在人体和动物实验中证实,缓激肽和血管舒张素是已知的最强烈的舒血管物质。在一些腺体器官中生成的激肽,可以使器官局部的血管舒张,血流量增加。
循环血液中的缓激肽和血管舒张素等激肽也参与对动脉血压的调节,使血管舒张,血压降低。
(六)心钠素
心钠素(cardionatrin)是由心房肌细胞合成和释放的一类多肽。在人的循环血液中,最主要的是一种由28个氨基酸构成的多肽。心钠素可使血管舒张,外周阻力降低;也可使每搏输出量减少,心率减慢,故心输出量减少。心钠素作用于肾的受体,还可以使肾排水和排钠增多,故心钠素也称为心房利尿钠肽(atrial natriuretic peptide)。此外,心钠素还能抑制肾的近球细胞释放肾素,抑制肾上腺球状带细胞释放醛固酮;在脑内,心钠素可以抑制血管升压素的释放。这些作用都可导致体内细胞外液量减少。
当心房壁受到牵拉时,可引起心钠素的释放。在生理情况下,当血容量增多、取头低足高的体位、身体浸入水中(头露出水面)时,血浆心钠素浓度升高,并引起利尿和尿钠排出增多等效应。因此,心钠素是体内调节水盐平衡的一种重要的体液因素。心钠素和另外一些体液因素在血压和水盐平衡的调节中还起相互制约的作用。内皮素和血管升压素也都能刺激心房肌细胞释放心钠素。
(七)前列腺素
前列腺素是一族二十碳不饱和脂肪酸,分子中有个环戊烷,其前体是花生四烯酸或其它二十碳不饱和脂肪酸。全身各部的组织细胞几乎都含有生成前列腺素的前体及酶,因此都能产生前列腺素。前列腺素按其分子结构的差别,可分为多种类型。各种前列腺素对血管平滑肌的作用是不同的,例如前列腺素E2具有强烈的舒血管作用,前列腺素F2α则使静脉收缩。前列环素(即前列腺素I2)是在血管组织中合成的一种前列腺素,有强烈的舒血管作用。
交感缩血管纤维末梢释放递质的过程受前列腺素调制。去甲肾上腺素和血管紧张素Ⅱ等缩血管物质作用于血管平滑肌相应的受体,引起血管平滑肌收缩,同时也使血管平滑肌生成前列腺素E2和前列环素。前列腺素E2和前列环素可使血管平滑肌对去甲肾上腺素和血管紧张素Ⅱ的敏感性降低。另一方面,血管平滑肌生成的前列腺素又可通过神经-平滑肌接头间隙作用于交感神经纤维末梢接头前的前列腺素受体,使交感纤维末梢释放递质减少。可见,前列腺素在交感神经-血管平滑肌接头处起着一种局部负反馈调节作用。
(八)阿片肽
体内的阿片肽有多种。垂体释放的β-内啡肽和促肾上腺皮质激素来自同一个前体。在应激等情况下,β-内啡肽和促肾上腺皮质激素一起被释放入血液。β-内啡肽可使血压降低。β-内啡肽的降血压作用可能主要是中枢性的。血浆中的β-内啡肽可进入脑内并作用于某些与心血管活动有关的神经核团,使交感神经活动抑制,心迷走神经活动加强。内毒素、失血等强烈刺激可引起β-内啡肽释放,并可能成为引起循环休克的原因之一。针刺穴位也可引起脑内阿片肽的释放。这可能是针刺使高血压患者血压下降的机制之一。
除中枢作用外,阿片肽也可作用于外周的阿片受体。血管壁的阿片受体在阿片肽作用下,可导致血管平滑肌舒张。另外,交感缩血管纤维末梢也存在接头前阿片受体,这些受体被阿片肽激活时,可使交感纤维释放递质减少。
(九)组胺
组胺是由组氨酸在脱羧酶的作用下产生的。许多组织,特别是皮肤、肺和肠粘膜的肥大细胞中含有大量的组胺。当组织受到损伤或发生炎症和过敏反应时,都可释放组胺。组胺有强烈的舒血管作用,并能使毛细血管和微静脉的管壁通透性增加,血浆漏入组织,导致局部组织水肿。
三、局部血流调节
体内各器官的血流量一般取决于器官组织的代谢活动,代谢活动愈强,耗氧愈多,血流量也就愈多。器官血流量主要通过对灌注该器官的阻力血管的口径的调节而得到控制。除了前述的神经调节和体液调节机制外,还有局部组织内的调节机制。在不同器官的血管,神经、体液和局部机制三者所起作用的相互关系是不同的,在多数情况下,几种机制起协同作用,但在有些情况下也可起相互对抗的作用。另外,不同器官的血流量变化范围也有较大的差别,功能活动变化较大的器官,如骨骼肌、胃肠、肝、皮肤等,血流量的变化范围较大;脑、肾等器官的血流量则比较稳定,在一定的血压变化范围内,器官血流量可保持稳定。
实验证明,如果将调节血管活动的外部神经、体液因素都去除,则在一定的血压变动范围内,器官、组织的血流量仍能通过局部的机制得到适当的调节。这种调节机制存在于器官组织或血管本身,故也称为自身调节。心脏的泵血功能也有自身的调节机制,已在本章第一节中叙述。关于器官组织血流量的局部调节机制,一般认为主要有以下两类:
(一)代谢性自身调节机制
组织细胞代谢需要氧,并产生各种代谢产物。局部组织中的氧和代谢产物对该组织局部的血流量起代谢性自身调节作用。当组织代谢活动增强时,局部组织中氧分压降低,代谢产物积聚增加。组织中氧分压降低以及多种代谢产物,如CO2、H+离子、腺苷、ATP、K+离子等,都能使局部的微动脉和毛细血管前括约肌舒张。因此,当组织的代谢活动加强(例如肌肉运动)时,局部的血流量增多,故能向组织提供更多的氧,并带走代谢产物。这种代谢性局部舒血管效应有时相当明显,如果同时发生交感缩血管神经活动加强,该局部组织的血管仍舒张。
前面提到,有一些体液因素也可在组织中形成,并对局部的血流量起调节作用,例如激肽、前列腺素、组胺等,由于这些物质都是特殊的体液因素,故在生理学中将它们归在体液调节中。
(二)肌源性自身调节机制
许多血管平滑肌本身经常保持一定的紧张性收缩,称为肌源性活动。血管平滑肌还有一个特性,即当被牵张时其肌源性活动加强。因此,当供应某一器官的血管的灌注压突然升高时,由于血管跨壁压增大,血管平滑肌受到牵张刺激,于是肌源性活动增强。这种现象在毛细血管前阻力血管段特别明显。其结果是器官的血流阻力增大,器官的血流量不致因灌注压升高而增多,即器官血流量能因此保持相对稳定。当器官血管的灌注压突然降低时,则发生相反的变化,即阻力血管舒张,血流量仍保持相对稳定。这种肌源性的自身调节现象,在肾血管表现特别明显,在脑、心、肝、肠系膜和骨骼肌的血管也能看到,但皮肤血管一般没有这种表现。在实验中用罂粟碱、水合氯醛或氰化钠等药物抑制平滑肌的活动后,肌源性自身调节现象也随之消失。
四、动脉血压的长期调节
动脉血压的神经调节主要是在短时间内血压发生变化的情况下起调节作用的。而当血压在较长时间内(数小时,数天,数月或更长)发生变化时,神经反射的效应常不足以将血压调节到正常水平。在动脉血压的长期调节中起重要作用的是肾。具体地说,肾通过对体内细胞外液量的调节而对动脉血压起调节作用。有人将这种机制称为肾-体液控制系统。此系统的活动过程如下:当体内细胞外液量增多时,血量增多,血量和循环系统容量之间的相对关系发生改变,使动脉血压升高;而当动脉血压升高时,能直接导致肾排水和排钠增加,将过多的体液排出体外,从而使血压恢复到正常水平。体内细胞外液量减少时,发生相反的过程,即肾排水和排钠减少,使体液量和动脉血压恢复。
肾-体液控制系统调节血压的效能取决于一定的血压变化能引起多大程度的肾排水排钠变化。实验证明,血压只要发生很小的变化,就可导致肾排尿量的明显变化。血压从正常水平(13.3kPa,100mmHg)升高1.3kPa(10mmHg),肾排尿量可增加数倍,从而使细胞外液量减少,动脉血压下降。反之,动脉血压降低时,肾排尿明显减少,使细胞外液量增多,血压回升。
肾-体液控制系统的活动也可受体内若干因素的影响,其中较重要的是血管升压素和肾素-血管紧张素-醛固酮系统。前已述,血管升压素在调节体内细胞外液量中起重要作用。血管升压素使肾集合管增加对水的重吸收,导致细胞外液量增加。当血量增加时,血管升压素减少,使肾排水增加。血管紧张素Ⅱ除引起血管收缩,血压升高外,还能促使肾上腺皮质分泌醛固酮。醛因酮能使肾小管对Na+的重吸收增加,并分泌K+和H+,在重吸收Na+时也吸收水,故细胞外液量和体内的Na+量增加,血压升高。
总之,血压的调节是复杂的过程,有许多机制参与。每一种机制都在一个方面发挥调节作用,但不能完成全部的、复杂的调节。神经调节一般是快速的、短期的调节,主要是通过对阻力血管口径及心脏活动的调节来实现的;而长期调节则主要是通过肾对细胞外液量的调节实现的。
-
《生理学》 中的相关章节:
……
第四节 血型与输血原则
第四章 血液循环
第一节 心脏的泵血功能
第二节 心肌的生物电现象和生理特征
第三节 血管生理
第四节 心血管活动的调节(当前页)
第五节 器官循环
第五章 呼吸
第一节 肺 通 气
第二节 呼吸气体的交换
……