第一节 补体固有成分的分子结构及功能
补体系统两条激活途径中,涉及到14个补体蛋白(C1-9,及B、D、P因子)的参与。近年来,由于分子遗传学和分子克隆技术的应用,已阐明许多补体分子的结构、功能、生物合成及遗传特征,从而大促进了人们对补体系统激活过程机理的认识和对各个补体分子功能的深入了解。
一、C1分子
C1是经典激活途径中的起始成分。它是由1个分子的C1q和2个分子的C1r及2个分子的Cls借Ca2+连接而成的大分子复合物。分子量约为750kDa。其中C1q为具有识别作用的亚单位,C1r和C1s为具有催化作用的亚单位。
(一)C1q
C1q为各种补体分子中分子量最大(410kDa)的γ球蛋白。其分子结构较特殊和复杂,由A、B、C三种不同类型的肽链所组成。其中A、B、C链各6条,共18条。A、B、C三种肽链的分子量不尽相同,分别为24、23和22kDa,各含有222-226个氨基酸残基,且彼此同源。每条肽链由含半胱氨酸残基的一个短的N末端区所组成,接着为一段81个氨基酸的胶原序列(即重复的三股序列Gly-X-Y,Y处通常为羟脯氨酸或赖氨酸残基)。该序列的其余部分为非胶原性的。A、B链间及两条C链间各有一个二硫键相连接。18条肽链中每三条不同的肽链组成一条三股螺旋,故共有6条这样的结构。每条螺旋的肽链均由丝状胶原样成分组成。在6条螺旋结构C端由于氨基酸序列的随机卷曲而形成6个花蕾状的球形头部,呈花朵形展开。在近N端约为1/2全长的螺旋结构呈束状并平行排列,其N末端为C1q的尾部。因此在电镜下观察,C1q分子的图像酷似一束盛开的郁金香花(图5-1)

图5-1 C1q的结构(模式图)
C1q的胶原样区有结合C1r和C1s的部位。并证实聚合的C1q刺激B细胞增强其产生Ig的作用,也是通过其尾部而完成的。C1q的关部含有能识别IgFc片段上补体结合部位的位点(C1q与C1q-R相互作用),且由于6个球形头部呈花朵形展开,更增加了其与Ig接触的机会。C1q同1个分子的IgM结合即可被活化,但至少需同两个IgG分子结合才能被活化,而且两个IgG分子在细胞膜上的距离不得少于700nm。C1q对人4种IgG亚类的结合亲和力依次为:IgG3>IgG1>IgG2>IgG4。
Reid等已对C1q分子的A、B链做了部分氨基酸分析,并完成了A、B链的cDNA克隆及序列分析。因此,C1q分子的大部分一级结构已经明确。编码C1qA、B、C三条肽链的基因均定位于人的第1号染色体的短臂34.1-36.1区。
(二)Clr和Cls
Clr和Cls均为单一多肽链分子,又都是丝氨酸蛋白酶(原)。Clr和Cls 多肽链均由接近700个氨基酸所组成。位于C末端的约250个氨基酸为丝氨酸蛋白酶区,与胰蛋白酶和糜蛋白酶同源。同大多数补体蛋白一样,它们都是镶嵌(mosaic)蛋白,即由不同氨基酸组成的固定基序组合而成,并且很可能代表独立的折叠功能区或结构功能域(module)。
电镜下观察表明,Clr和Cls的分子构型极为相似,均呈一端大一端稍小的哑铃状分子。

图5-2 Clr/Cls分子的结构
两个分子的Clr和同等分了的Cls借Ca2+连接成扭曲的“8”字形,盘架于C1q近头部的6条螺旋结构间(图5-3)。Clr和Cls的分子量条螺旋结构间(图5-3)。Clr和Cls的分子量均为85kDa。它们激活后,在分子内的精氨酸与亮氨酸残基间断裂,形成分子量分别为57kDa和28kDa的A、B两个片段,但链间仍以二硫键相连接,故整个分子并末分离。在B片段上含有丝氨酸蛋白酶活性点,为其催化英勇区(图5-2)。A片段上有Clr和Cls相互反应的的功能区。反应功能区朝向中心,催化功能区位于外侧。在一般C1INH与C1r结合着,而一旦有免疫复合物结合到Clq时,C1INH的抑制作用即行移除,并通过C1q的胶原性柄将其头部的移动传递到其核心区,并从此处再传递到与其相连接的C1r,诱导C1r构钟爱改变并裂解活化。活化的C1r(C1r),再作用于C1s使之成为活化型C1s(C1s)。
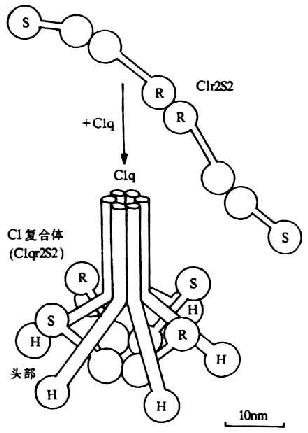
图5-3 C1分子(C1q、C1r和C1s)的结构(示意图)
目前C1r和C1s的cDNA克隆均已成功,并进行了全部序列分析。编码C1r的基因定位于人的第12号染色体短臂13-ter,与编码C1s的基因相连。
二、C4分子
C4是经典激活途径中第二个被活化的补体成分,分子量约为210kDa,由α(90kDa)、β(78kDa)及γ(33kDa)三条肽链借二硫键连接组成(图5-4)C4的分子结构较为特殊,其α链中含有一个在半胱氨酸和谷氨酸残其间形成的内硫酯键。α链的N端有C1s丝氨酸蛋白酶的作用点。当C1s将C4α链的精氨酸-丙氨酸键(76-77位)裂解后,形成大小不等的两个片段。小片段C4a(8.6kDa)释放入液相中,其为一弱的过敏毒素,具有激酞样作用,可诱导肥大细胞释放组胺,增加血管的通透性引起局部渗出性炎症,但其活性不到C3a或C5a的1%。大的片段C4b其α`链的内硫酯键被水解,并暴露出一个自由的硫氢基和一个谷氨酰胺残基的高度反应性酰基,通过转酯反应而将C4b固定到膜固相上。但C4b只能在其产生处或附近部位结合,因高度反应性的酰基能迅速与H2O反应,生成稳定的无共价结合功能的羧基(详见图5-7)。
一个C1s丝氨酸蛋白酶可以裂解多个C4分子,但产生的C4b只有1/10能结合到膜固相上,而且其中也仅少数与C2结合。C4b的功能,除主要参与经典激活途径中C3转化酶(C4b2a)和C5转化酶(C4b2a3b)的形成进一步介导补体后续成分的级联反应外,还可通过与效应细胞膜上的CR1结合促进吞噬、调节补体活化,以及参与防止免疫复合物的沉积及中和病毒的作用。近年认为,C4可能与免疫识别及维持免疫自稳功能也有关。
编码人C4的基因定位于第6号染色体的HLA-DR和HLA-B位点间一段基因组DNA上。C4由两个基因C4A*和C4B*所编码,因此血清中的C4分子也有两种类型即C4A和C4B,但二者具有高度同源性(仅有少数氨基酸不同)目前C4A*和C4B*的cDNA克隆均已成功并进行了序列分析。C4A、C4B、B因子及C2均属于MHC的第Ⅲ类分子。
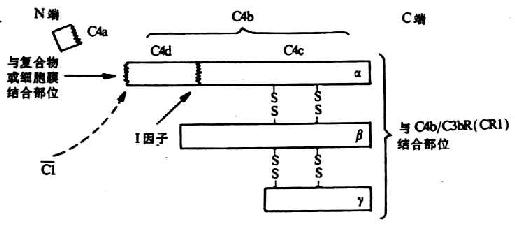
图5-4 C4分子其裂解片段(模式图)
三、C2分子
C2的序号似是补体的第2个成分,但在经典激活途径的激活顺序上却在C4以后被活化。C2分子的一级结构已全部搞清楚,它是由723个氨基酸残基组成的单肽链糖蛋白,分子量约110kDa(图5-5)。当C2与已固定于细胞膜固相上的C4b结合为复合物时,C1s丝氨酸蛋白酶可从C2肽链的精氨酸和赖氨酸(223-234)间,将C2裂解为两个片段,即C2a和C2b。C2b由N端223个氨基酸残基构成,分子量为35kDa,由细胞膜表面释放入液相中,其生物学活性至今不明。C2a由509个氨基酸残基组成,分子量为75kDa,它是构成经典激活途径中C3转化酶(C4b2a)和C5转化酶(C4b2a3b)的酶原部分。C2a的肽链上含有裂解C3和C5的蛋白酶活性点,C3转化酶与C5转化酶对C3和C5的裂解,均是由C2a的酶活性点起催化作用。

5-5 C2分子的结构(模式图)
注:Ⅰ、Ⅱ、Ⅲ为3个SCR
通过对C2的cDNA序列和氨基酸序列分析发现,C2与B因子间具有结构上的同源性。其中C2a与Bb同源,均含有裂解C3和C5的酶活性点;C2b和Ba同源,均由3个约60个氨基酸残基的短同源重复序列(shortconsensus repeat,SCR)构成。编码C2的基因定位于人的第6号染色体短臂21区(基因长度8kb)。
四、C3分子
C3处于两条激活途径的汇合点,在补体系统活化过程中起着枢纽作用,并为替代途径激活的关键分子。C3的α、β两条肽链组成,之间以二硫键相连结,分子量为195kDa,其中α链为115kDa,β链为75kDa(图5-6)。其在血清中的含量高于其它补体分子,约为0.55-1.2mg/ml。同C4分子一样,C3分子的α链在半胱氨酸和谷氨酸残基之间也有一个内硫酯键(Cys-S-CO-Glu)。此环状结构水解后,可形成一个转移性结合点,认为这是C3b由液相结合到固相上的结构条件,也是C3以缓慢的速率水解导致其构象改变出现能与B因子具有亲和力的“变构”C3b的分子基础。当C3转化酶从C3α链N端一个精氨酸-丝氨酸键(第77-78位)外将C3裂解后,可产生一个9kDa的小片段C3a(释放到液相中去),其余部分为C3b。同时,新生的C3bα`链内距N端5kDa的硫酯键断裂,在谷氨酰胺基上出现一个具有转酯作用的高度或多糖等分子中的羟基(R-OH)共价结合,形成新的酯键。同样,也可与靶细胞上的氨基形成酰键(-CONH-)。这样,新生的C3b便可结合于靶细胞表面,而其半胱氨酸则通过接受1个质子形成硫氢基(-SH),从而获得转移性。需要提及的是,上述形成的反应性酰基极不稳定,若在60秒内未同碳水化物发生转酯反应,则反应性酰基即与水分子反应形成羧基,从而使C3b失去共价结合的能力(图5-7)。一般细胞表面都有足够的糖类(常以糖蛋白、糖脂或多糖形式存在)因此新生C3b得以通过上述转酯作用而固定于细胞上(外来的或自身的)。通过上述转酯反应而获得结合活性的C3b可与c
4b2a结合形成经典途径的C5转化酶(C4b2a3b),或与Bb结合形成替代途径的C3转化酶(C3bBb)和C5转化酶(C 3bnBbC3b也可在H因子和I因子的作用下,变为无活性的C3bi,并再I因子裂解为C3dg和C3c(图5-8)。C3d可能是C3裂解的最终产物,只有在细菌或炎灶分解产物的作用下,才能裂解为C3d和C3c。还报道有C3e片段,可能来源于C3c。
C3各个裂解片段的生物学活性不一。C3a为过敏毒素,能直接作用于肥大细胞和嗜性粒细胞,使之释放组胺,引起血管扩张,通透性增加,平滑肌收缩及局部水肿。但其作用远较C5a弱。此外,C3a还具有使吞噬细胞定向移动以促进吞噬的趋化作用,以及抑制特异抗体反应、非特异性多克隆反应和抑制白细胞移动抑制因子(LIF)产生的作用。C3b的生物学活性烄广,概括起来有以下几个方面:(1)参与替代途径中两种C3转化酶[起始C3转化酶(C3bB)和放大C3转化酶(C3bBb)],以及两条途径中两种C5转化酶(C4b2a3b和C3bnBb)的形成;(2)启动替代激活途径中的正反馈放大回路;(3)调理促进吞噬及免疫粘连作用;(4)参与免疫调节,如作为B细胞活化的非特异性刺激信号,作为B细胞的致有丝分裂原促进B细胞增殖,与抗体协同增强ADCC作用和刺激单核细胞释放前列腺素E(PGE),嵌入抗原、抗体复合物的网格结构中,使二者的结合键断裂从而是产生对可溶性免疫复合物的溶解作用等。C3bi具有促进吞噬和与抗体协同增强ADCC反应的作用。C3c和C3dg可的抑制抗原、有丝分裂原或同种异型抗原诱导的T细胞增殖,C3e则可引起白细胞增多。
人的C3基因定位于第19号染色体,有两种常见的同种型C3S和C3F。此外还有十余种少见型及罕见型,其中C3F与肾小球毛细血管性肾炎和部分脂质性营养不良有关。C3遗传性缺陷少见,但如发生缺陷,则易引起反复化脓性和革兰氏阴性菌的感染。
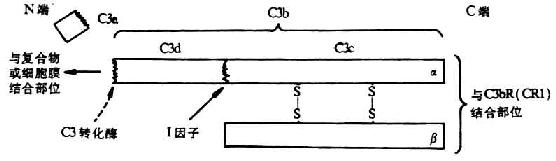
图5-6 C3分子的结构(模式图)
五、C5分子
C5是形成膜攻击复合体(MAC)的第1个补体分子。C5由以二硫键相连接的α、β链组成,分子量190 kDa,其中α链为115kDa,β链为75kDa(图5-9)。C5与C3和C4的结构相类似,但没有链内硫酯键。靠近N端的第74-75位精氨酸一亮氨酸键为C5转化酶作用的部位。在C5转化酶的作用下,C5α链N末端裂解出一个分子量为11kDa的小片段C5a进入液相中,其余部分为110kDa的大片段C5b,仍结合在细胞膜表面。亲生的C5b在极短时间内能保持与C6结合的构象,可与C6非共价结合形成一牢固的C5b6复合物,并通过与C3b的可逆性结合而固定的细胞膜上。但C5b生成后其潜在的生物学活性存在时间非常短促,若无C6结合则迅速衰变为C5bi。
C5b只形成MAC参与细胞溶解效应,而C5a却具有广泛的生物学活性。概括起来有以下几方面:(1)过敏毒素作用:C5a是具有过敏毒素作用的补体裂解片段中作用最强的介质,较C3a强20倍,较C4a强2500倍。此外,C5a还可不依赖于肥大细胞释放组胺,即通过直接作用于血管内皮细胞而增加血管的通透性。(2)趋化作用:高浓度的C5a是中性粒细胞、嗜酸性粒细胞和单核细胞的趋化剂,可刺激这些细胞沿着浓度定向移动。值得注意的是,被血清羧肽酶N切C5a C端精氨酸残基而形成的去精C5a虽丧失了使肥大细胞分泌组胺的能力,但仍具有较强的趋化活性,是补体活化后产生趋化作用的主要因素。(3)促代谢作用:高浓度的C5a可刺激中性粒细胞和单核细胞的氧化代谢,提高其cGMP的水平,有利于促进溶酶体与细胞膜的融合,释放溶酶体酶。此外,C5a还可刺激中性粒细胞粘附及增强其产生超氧化物。(4)免疫调节作用:近年体外研究表明,C5a对免疫应答有明显增强作用,如可诱导单核细胞分泌IL-1、IL-6、IL-8及TNF-α等细胞因子,促进抗原及同种异体抗原诱导的T细胞增殖及B细胞产生抗体等。C5a的上述生物学活性的利于增强机体的防御机能,但由其导致的炎症反应也可造成对机体的损伤。编码入C5的基因定位于第9号染色体长臂32-34区。
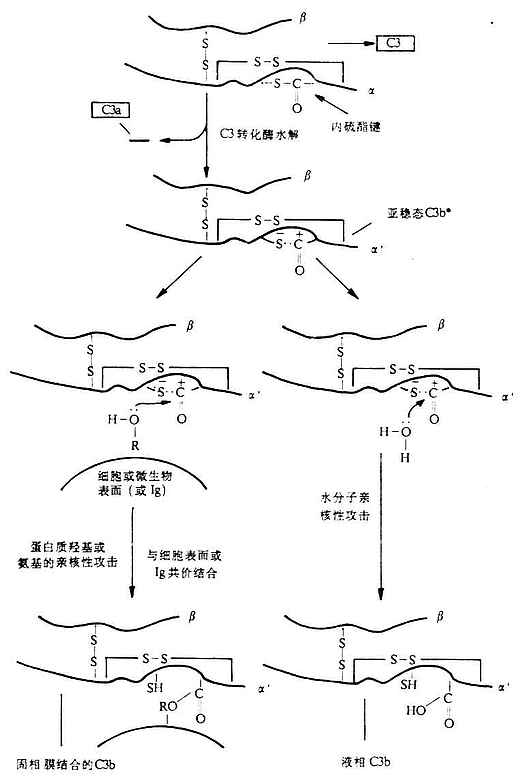
图5-7 C3b的酯化反应(图解)
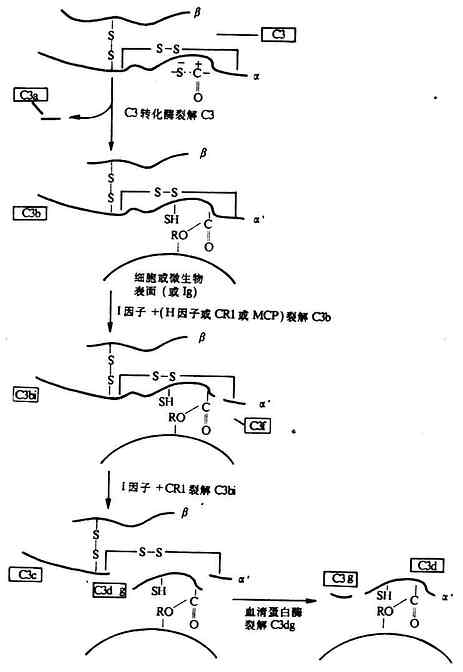
图5-8 C3各种裂解片段的产生(图解)
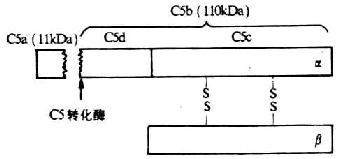
图5-9 C5分子的结构(模式图)
六、C6和C7
C6和C7有许多相似之处,均为单链糖蛋白,且分子量也相近分别为128kDa和121kDa。编码C6和C7分子的基因可能由共同的祖基因进化而来。C6和C7在氨基酸水平上有33.5%的同源性。近几年来,对C6的结构及功能进行了较深入的研究,由cDNA序列推导成熟C6的全部多肽链含有913个氨基残基,前面还有21个独特氨基酸残基组成的信号肽,其碳水化物的含量为4-6%。在肽链的第303位和834位氨基酸残基处,可能为两个天冬酰胺连接的糖基化部位。C6中还含有大量的半胱氨酸残基(总数为64个),集中在多肽链的氨基末端和羧基末端部分,其中氨基末端的位置由半胱氨酸残基所占据。
C6和C7中都含有低密度脂蛋白(LDL)受体结构功能域、EGF前体结构功能域、Ⅰ型凝血敏感蛋白(TSP-1)结构功能域和SCR结构功能域,且排列方式相同。应用滤纸结合的C6片段进行研究表明,C6与C5b的结合部位为由2个SCR和2个Ⅰ因子结构功能域(FIMs)所组成的大小为34kDa的羧基末端的片段。在C6和C7活化过程中,二者均无分子的裂解,推测可能是由于其分子构型的改变而成为具有结合活性的形式。C6和C5b以非共价形式结合形成的C5b6复合物仍疏松的与C3b呈可逆性结合,且具有亲水性不能插入膜内。而一经与C7结合,即出现亲水-疏水两性转换,同时产生亚稳态膜结合部位。这样,c
5b67便脱离C3b附着部位转移至膜表面,然后通过复合物中C7的疏水性紧紧固定在膜脂质双层中。疏水区的暴露系由于C5b67复合物的构象变化所致。但新生的亚稳态C5b67复合物仅有100毫秒的生存其,如不及时同膜结合,又可因复合物重排使疏小区折叠而失去膜结合活性。此外,无论液相或结合到膜上的C5b67复合物均可自行聚合而丧失其介导的溶细胞活性,但仍具有趋化作用。C6和C7可能还有触发淋巴细胞母细胞化的作用,因在单相混合淋巴细胞反应(MLR)中,加入抗C6及C7的抗体Fab能抑制淋巴细胞增殖。
编码C6和C7和的基因定位于人的第5号染色体上且相连锁。C6及C7均具有遗传多态性,编码C6的两个等位基因(C6A和C6B)已确定,东方人群中C6B的基因频率较高。C6及C7的cDNA已克隆成功,发现它们与C8和C9具有一定的同源性。
七、C8分子
C8是由α、β、γ三条肽链组成的三聚体糖蛋白,分子量为155kDa。其中α链和β链均为64kDa,γ链为22kDa。α链和γ链间以二硫键共价结合,而α链与β链间则为非共价键结合(图5-10)。C8分子中也含有TSP-1和LDL受体结构功能域。在C8α和C8β多肽链的中央(157-501个氨基酸残基间),几科不含半胱氨酸残基,为与细胞毒性T细胞及NK细胞产生的穿孔蛋白(perforin)有同源性的结构功能域。在α和β链中含有极高比使的疏水性氨基酸。β链分布在C8分子的表面,其与C5b的相互作用是极性的,并具有高度特异性。C8与C5b-7的结合部位为其β链。当C8与c 5b-7结合后,通过C8分子的构象变化,使其α链插入膜脂质双层的烃核中,形成直径约1.6nm的空膜孔道,可使细胞同的离子缓缓流出,但不会导致细胞溶解。C5b-8复合物能促使C9的聚合但机理尚不清楚,可能是降低了C9聚合的活化能所致。另外研究表明,C9是通过C8而同c 5b-8结合的,因C9不能同C5b-7相结合,而其同C5b-8的结合则可被抗C8的抗体所抑制。

图5-10 C8分子的结构(模式图)
C8的基因定位较复杂,其中编码α链和β链的基因C8A和C8B定位于人的第1号染色体,而编码γ链的基因C8G则定位于第9号染色体的长臂。目前已对C8β链的cDNA克隆成功,并做了序列分析,发现其与C9具有高度的同源性,而且二者均含有丰富的半胱氨酸的膜嵌入区。C8的α链和β链在遗传上也呈高度多态性,二者约有33%的氨基酸序列相同,而与C7和C9则约25%相同
八、C9分子
C9是形成膜攻击复合体(MAC)的最后个分子,为一单链糖蛋白,分子量79kDa。经对cDNA推导的氨基酸序列分析发现,C9为一两性分子。C端37kDa由疏水性氨基酸组成称C9b,N端34kDa由亲水性氨基酸组成称C9a因此C9以其羧基端部分嵌入细胞膜的脂质双层中。而N端则为与c 5b-8相结合的结构域。C9具有自发聚合的作用,但聚合很慢,在37℃下需3天才能完成,而在C >5b-8的催化下,10分钟内即可完成。由12-16个C9分子聚合形成的多聚体C9,可形成内径10nm、壁厚2nm的中空穿膜孔道嵌入膜内(图5-11)。孔道的内面由许多亲水性氨基酸残基和碳水化物组成,而与双层脂接触的管壁外面则是疏水性氨基酸残基。由于细胞内容物的外漏,最终可导致细胞溶解破坏。C9分子的多肽链与C8α和C8β结构上相类似,也含有TSP-1、LDL受体前体结构功能域及与穿孔蛋白同源的结构功能域。由于C9和穿孔蛋白在结构和功能上均非常相似,推测二者可能具有共同的祖基因。编码入C9的基因定位于第5号染色体上,末发现C9有多态性。
九、B因子
B因子(factor B,Bf)替代激活途径中的重要成分,由Blum于1959年首先发现。B因子为由733个氨基酸残基组成的单链糖蛋白(糖含量约7%),分子量93kDa。由于这些氨基酸的迂回折叠形成三个大小相近似的球形区。其中1个为Ba,其余两个呈哑铃状为Bb。Bb中靠近N端的一个球形区可同C3b结合,另一个球形区可能是催化区(图5-12)。在Mg2+存在的情况下,B因子可与C3b结合形成C3bB,被血清中的D因子裂解为分子量为33kDa的Ba和63kDa的Bb两个片段。后者3再与C3b结合形成替代途径的C3转化酶(c3bBb)和C5转化酶(C3bnBb)。两种酶中的Bb均具有丝氨酸蛋白酶活性,是裂解C3和C5的活性部位,但C 3bBb和C 3bnBb均不稳定,易衰变失去活性。
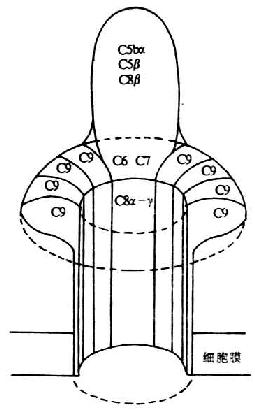
图5-11 膜攻击复合体(MAC)的结构(模式图)
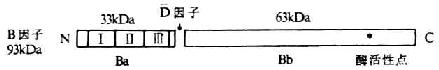
图5-12 B因子的结构(模式图)
注Ⅰ、Ⅱ、Ⅲ为3个SCR
近年研究发现,B因子的两个裂解片段还具有免疫调节作用。其中Bb能促进经金黄色葡萄球菌Cowan I株(SAC)刺激活化的B细胞增殖,而Ba则对B细胞生长因子(BCGF)诱导的进入活化状态的B细胞增殖有明显抑制作用,且呈浓度依赖关系。B因子和C2均属于补体超家族的成员,二者的编码基因紧密连锁。编码B因子的基因定位于人的第6号染色体短臂21区,基因长度6kb,含18个外显子。
十 、D因子
D因子是启动替代途径激活的重要成分,为由222个氨基酸残基组成的单链丝氨酸蛋白酶,分子量仅25kDa。D因子在血清中的浓度很低(1-2μg/ml),主要以活化形式而存在。但可能还有一种以酶原形式而存在的由239个氨基酸残基组成的D因子。具有活性的D因子(D)可能在第234-235位的精氨酸-赖氨酸键处将B因子裂解为Ba和Bb两个片段,从而启动替代途径的级联活化反应。D因子的部分cDNA已克隆成功,并进行了序列分析,发现其与其它几种丝氨酸蛋白酶(如胰蛋白酶、糜蛋白酶、纤溶酶及弱性蛋白酶)具有同源性。
十一、P因子
P因子又称备解素(properdin),是替代途径中除C3以外最先发现的一种血浆蛋白。现已探明,P因子以聚合体形式而存在:即三聚体(54%)、二聚体(26%)和四聚体(20%)都有,但特异活性的顺序依次为:四聚体>三聚体>二聚体。P因子为由4条相同的肽链(分子量各55kDa)组成的四聚体分子,链间以非共价键相连接,分子量为220kDa。P因子的生物学活性是以高亲和力与c 3bBb和C 3bnBb相结合,结合后通过发生构象改变而加固C3b与Bb间的结合力,从而可使其半衰期由2分钟延长至26分钟。另外,P因子还可封闭H因子的抑制作用,更增加了上述两种酶的稳定性及活性,有利于促进替代途径级联反应的继续进行。因此,P因子实际上是替代途径中的一个重要的正调节分子。因其常成为c 3bBb和C3bnBb复合物中的组成成分之一,故将其作为补体系统的固有成分在此一并描述。此外,在膜增生性肾小球肾炎病人血清中发现有一种C3肾炎因子(C3nephritic factor,C3NeF)实际为C 3bBb的自身抗体,也可与C3bBb结合而增加c 3bnBb的稳定性,使其半衰期处长10-30倍。
关于上述14种补体固有蛋白的特性及其生物学活性见表5-1。
表5-1 补体固有成分的特性及生物学活性
| 补体成分 | 血清浓度(μg/ml) | 分子量(kDa) | 亚单位(链)及分子量(kDa) | 激活产物 | 生物学活性 |
| C1q | 75 | 410 | A:24各6条 | 识别IgG、IgM Fc的补体结合点 | |
| B:23各6条 | |||||
| C:22各6条 | |||||
| C1r | 50 | 85 | 1条 | C1r | 丝氨酸蛋白酶,裂解C1s |
| C1s | 50 | 85 | 1条 | C1s | 丝氨酸蛋白酶,裂解C4、C2 |
| C4 | 200-500 | 210 | α:90 | C4a | 弱的过敏毒素作用 |
| β:78 | |||||
| γ:33 | C4b | 组成CP中的C3、C5转化酶,促进吞噬、防止IC沉积、中和病毒、免疫识别及维持自身稳定等 | |||
| C2 | 20 | 110 | 1条 | C2b | 不详 |
| C2a | 丝氨酸蛋白酶,组成CP中的C3、C5转化酶 | ||||
| C3 | 550-1200 | 195 | α:110 | C3a | 过敏毒素、趋化作用等 |
| β:85 | C3b | 组成CP、AP中的C3、C5转化酶,调理促吞噬、免疫粘附及免疫调节作用 | |||
| C5 | 70 | 190 | α:115 | C5a | 强的过敏毒素作用、趋化作用、 |
| β:75 | 促代谢作用及免疫调节作用 | ||||
| C5b | 形成C5b67复合物具有趋化作用 | ||||
| C6 | 60 | 128 | 1条 | 组成MAC,触发淋巴细胞母细胞化 | |
| C7 | 60 | 121 | 1条 | 组成MAC的成分 | |
| C8 | 60 | 155 | α:64 | 组成MAC的成分,促进C9聚合 | |
| β:64 | |||||
| γ:22 | |||||
| C9 | 60 | 79 | 1条 | 组成MAC并聚合形成跨膜孔道 | |
| B因子 | 200 | 93 | 1条 | Ba | 抑制人的B细胞增殖 |
| Bb | 丝氨酸蛋白酶,组成AP中的C3、C5转化酶 | ||||
| D因子 | 1~2 | 25 | 1条 | D | 丝氨酸蛋白酶,裂解B因子 |
| P因子 | 25 | 220 | 4条,各55 | 稳定AP中的C3、C5转化酶 |
注:CP:红典激活途径;AP:替代激活途径;MAC:膜攻击复合体
-
《细胞和分子免疫学》 中的相关章节:
……
第二节 细胞因子的结构和生物学特征
第三节 细胞因子受体
第四节 细胞因子及其受体的检测
参考文献
第五章 补体的分子生物学
第一节 补体固有成分的分子结构及功能(当前页)
第二节 补体调节分子的结构及功
第三节 补体受体的结构及功能
第四节 补体的结构及遗传学特征
参考文献
……