第三节 抗原的抗原性
自发现抗体后,用血清学方法在体外实验,证明了天然抗原与其相应抗体发生特异性结合,这是一个重要的免疫学现象,称这种特性为抗原的抗原性。在早期由于尚未建立对蛋白质抗原进行分析的方法,为研究抗原性的化学本质造成了困难。奥地利免疫化学家Landsteiner在本世纪20年代创建了人工结合抗原,并应用血清学方法对抗原性的化学本质进行了系统的研究,为抗原、抗体的相互作用提供了大量知识,为天然抗原化学性质的研究奠定了基础。
一、人工结合抗原
Landsteiner首创用已知化学结构的低分子化合物或化学基团与免疫原性蛋白质进行偶联,制备了偶氨蛋白。由于低分子化合物本身无免疫原性,单独免疫动物不能对其产生抗体,如与蛋白质偶联再免疫动物则能对其产生抗体,并能单独与其抗体结合。故称此种无免疫原性低分子化合物为半抗原(hapten,H),称免疫原性蛋白质为载体(cauuier,C)自此建立了半抗原与载体的概念(H-C)。因此可以认为半抗原是外加在免疫原分子上的已知化学结构的化学基团,在一定意义上它与抗原分子上未知化学结构的天然抗原决定簇是同义语(图10-1)。
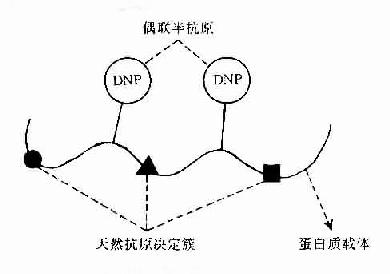
图10-1 半抗原载体结合物
常用为载体的免疫原性蛋白质有牛血清蛋白(BSA)、牛血清丙种球蛋白(BGG)、卵清蛋白(OA)、鸡丙种球蛋白(CGG)、钥孔嘁血蓝蛋白(KLH)及人工合成多聚赖氨酸(PLL)等。常用为已知结构的半抗原有二硝基苯酚(DNP)和三硝基苯酚等低分子化分物。
Landsteiner有带有不同酸基的有机物为半抗原,分别与同一种载体偶联制备了几种酸基不同的半抗原载体结合物,然后免疫动物。用所得抗体与已知半抗原进行体外补体结合实验,结果证明,带不同酸基的半抗原只能与其相应抗体结合。同理,他用氨基苯甲酸的三种异构物(邻位、间位、对位)分别与同一种载体蛋白偶联的半抗原载体结合物,只能与其相应抗体结合(表10-1,2)。上述实验证明,抗原与抗体的特异结合是与抗原分子表面的特殊结构的化学基团相关。将抗原分子表面能与其抗体结合的部位称为抗原决定簇,即抗原的抗原性是由其抗原决定簇的性质、数目和空间构型所决定,自此建立了抗原决定簇的概念。为以后研究天然蛋白质的抗原性提供了理论依据。
表10-1 不同酸基对半抗原与抗体反应特异性的影响
| 半抗原 | ||||
| 抗下列半抗原-载体 免疫血清 | 苯胺NH2 | 对氨基苯甲酸NH2 | P对氨基苯磺酸 | 对氨基苯砷酸 |
| 载体-苯胺 载体-对氨基苯甲酸 载体-对氨基苯磺酸 载体-对氨基苯砷酸 | +++ - - - | - ++++ - - | - - ++++ - | - - - +++ |
表10-2 化学基团(COOH)位置对半抗原体反应特异性的影响
| 半抗原 | ||||
| 抗下列半抗原-载体 免疫血清 | 苯胺 | 氨基苯甲酸 | ||
| 邻位 | 间位 | 对位 | ||
| 载体-苯胺 载体-邻位氨基苯甲酸 载体-间位氨基苯磺酸 载体-对位氨基苯砷酸 | +++ - - - | - ++++ - - | - - ++++ - | - - - +++ |
+:阳性反应;-:阴性反应
抗原除与其相应抗体发生特异反应外,也可与其它相关抗体发生反应,称这种现象为交叉反应。这是由于在二种不同的抗原分子中具有相同的抗原决定簇引起的,称为共同簇或共同抗原.也可能由于二种不同决定簇具有相似的结构,但并非相同,也能引起交叉反应。在发生学上较近的种属间,其抗原产生的抗体,彼此间易出现交叉反应。如牛血清清蛋白(BSA)与其它种属清蛋白之间的交叉反应(表10-3)。
表10-3 牛血清蛋白与其它种属清蛋白的交叉反应
| 清蛋白来源 | 交叉反应%(BSA) | 清蛋白来源 | 交叉反应 %(BSA) |
| 人 猪 羊 马 地鼠 | 15 32 75 13 13 | 豚鼠 狗 小鼠 大鼠 猫 | 5 13 10 17 25 |
二、载体决定簇与半抗原决定簇
单独应用半抗原不能诱导机体产生抗体,只有将半抗原与载体蛋白结合后,才能诱导机体既能产生抗载体蛋白抗体,也能产生半抗原抗体,已为实验所证明。这就提出了为什么单独应用半抗原不能产生抗体,载体在抗体产生中发挥什么作用等问题。
为了回答上述问题,有的学者应用牛血清蛋白-二销基苯(BSA-DNP)和卵白蛋白-二硝基苯(OA-DNP)为载体结合半抗原,观察了载体在抗体产生中的作用,他们首先应用BSA-DNP对小鼠进行初次免疫,然后再分别应用BSA-DNP和OA-DNP进行再次免疫,观察载体对抗DNP抗体产生的影响.他们发现,只有当初次与再次免疫时,半抗原需要在相同载体上才能产生半抗原抗体,称此为载体效应(表10-4)。证明载体不是单纯起运载半抗原的作用,而是具有载体特异性。因此提出一个完全抗原分子,必须具有载体决定簇和半抗原决定簇。
表10-4 载体-半抗原效应
| 实验组别 | 初次免疫 | 再次免疫 | 抗DNP抗体 |
| 1 2 3 | BSA-DNP BSA-DNP BSA-DNP+OA | BSA-DNP OA-DNP OA-DNP | +++ + +++ |
其后Mitchison等在70年代应用载体效应过继转移实验,证明了在抗体形成过程中,有对载体特异的细胞和对半抗原特异的细胞,分别称为载体反应细胞和半抗原反应细胞。并进一步证明T细胞是载体反应细胞,对抗体产生起辅助作用。B细胞是半抗原反应细胞,是产生抗体的细胞,自此阐明了载体效应的细胞学基础。
载体-半抗原概念极其重要,它可解释为什么低分子量化合物与体内载体蛋白质分子结合诱发超敏性反应产生的药物过敏症。如苯胺类染料、镇静剂司眠脲、退热剂阿司匹林、氨基比林以及多种抗生素分解产物等是诱发药物过敏症的原因。
三、天然蛋白质的抗原性
绝大多数免疫原性物质是大分子蛋白质或细胞组分,但只是其有限的部位能与其相应抗体结合,此部位称为抗原决定簇或表位(前述载体-半抗原效应已证明一个抗原分子须有T细胞决定簇和B细胞决定簇)。由于天然大分子蛋白质结构复杂,并具有空间构型,因此对其单一抗原决定簇的化学组成、定位及其结构研究十分困难。但近年来由于免疫化学技术的发展,已能研究其空间结构,由于单克降抗体技术的发展,已能分离鉴定单一抗原决定簇,因此,对蛋白质抗原性的研究已取得很大进展。
(一)B细胞决定簇(表位)
抗原分子的B细胞决定簇大小不同,其最大表面积约为50~70mm约由4~6氨基酸残基或糖基组成。100个氨基酸残基多肽可有14到20个非重叠决定簇,由线状排列彼此相邻的氨基酸组成,故称为线性或连续性决定簇。而球蛋白是有三维空间的折叠肽链,故其大多数决定簇被掩盖在内部,可称为隐蔽性决定簇。只存在于其表面的决定簇可被免疫细胞识别,或与抗体结合者称为功能性决定簇(图10-2)。组成这种决定簇的氨基酸,是由折叠的肽链将有同位置的氨基酸使之相邻成为有一定空间构型的决定簇,故称为构像决定簇或不连续决定簇。现已证明抗原分子的抗原性是由其组成的氨基酸予列、空间构型及其决定簇片段的移动决定的。
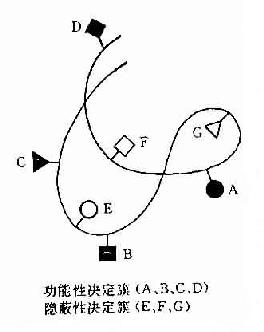
图10-2 球蛋白分子抗原决定簇
在球蛋白分子表面可带有多种抗原决定簇,其中有些决定簇更容易与淋巴细胞接触,比其它决定簇能激发较强的免疫应答,称这种决定簇为优势决定簇。每个抗原分子上其功能性决定簇的总数称为抗原价,即能与抗体分子起反应的最大数量的抗原决定簇,一般分子量大于10万者可有2个抗原价,大分子如分子量为40万者可有10~12个抗原价。
(二)T细胞决定簇(表位)
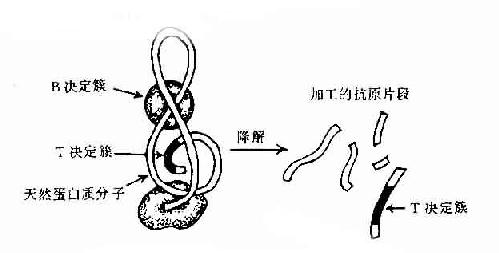
图10-3 抗原分子的T与B决定簇
现已证明T细胞决定簇为免疫原性多肽片段,属连续性决定簇。但它不存在天然蛋白分子表面,必须经抗原呈递细胞加工处理为小肽分子,然后再与自己MHC分子结合才能被T细胞所识别。而B细胞决定簇可存在于天然抗原分子表面,不须经加工处理,即可直接被B细胞所识别(图10-3)。
在天然大分子蛋白质抗原直接证明其存在有T细胞决定簇和B细胞决定簇是十分困难的。但用小分子已知结构的免疫原进行研究已证明其存有2种决定簇。胰腺高血糖素激素(glucagon)由29个氨基酸组成,有免疫原性。由其产生的抗激素抗体可识别其氨基末端。由其产生的杀伤T细胞可识别其羧基末端,相当于激素分子的载体部分。由此证明胰高血糖素分子的氨基端为B细胞决定簇,而羟基端为T细胞决定簇(图10-4)。
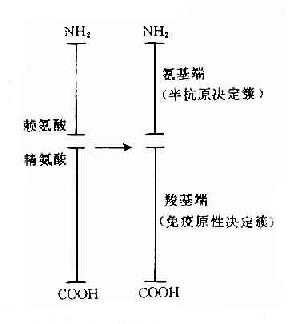
图10-4 高血糖素决定簇结构示意图
-
《医学免疫学》 中的相关章节:
……
第二篇 免疫系统的生理功能
免疫应答
第十章 抗原
第一节 抗原的概念和特性
第二节 抗原的免疫原性
第三节 抗原的抗原性(当前页)
第四节 抗原的分类
第十一章 免疫应答(一):B细胞介导的体液免疫
第一节 免疫应答的概念与过程
第二节 抗体产生的细胞学基础
……