第二节 粘附分子
粘附分子(adhesion molecules,AM)是指介导细胞与细胞间或细胞与基质间相互接触和结合的一类分子,大都为糖蛋白,分布于细胞表面或细胞外基质(extracellular matrix,ECM)中。粘附分子以配体受体相对应的形式发挥作用,导致细胞与细胞间、细胞与基质间或细胞-基质-细胞之间的粘附。参与细胞的信号传导与活化、细胞的伸展和移动、细胞的生长及分化、肿瘤转移、创伤愈合等一系列重要生理和病理过程。
目前按粘附分子的结构特点,可将其分为粘合素超家族的粘附分子、免疫球蛋白超家族的粘附分子、选择凝集素家族粘分子、钙离子依赖的细胞粘附素家族粘附分子及其它未归类的粘附分子。
一、粘合素超家族
粘合素超家族(integrin superfamily)的粘附分子主要介导细胞与细胞外基质的粘附,使细胞得以附着而形成整体(integration),故得名。此外,粘合素超家族的粘附分子还介导白细胞与血管内皮细胞的粘附。
(一)粘合素分子的基本结构
粘合素超家族的粘附分子都是由α、β两条链由非共价键连接组成的异源双休(heterodimer)。α链的分子量为120~180kD,β链的分子量为90~110kD,不同的α链(或称亚单位)或β链(或称亚单位)氨基酸组成和序列有不同程度的共源性,在结构上有其共同的特点。α和β亚单位均由胞浆区、穿膜区、胞膜外区三部分组成。胞浆区一般较短,可能与细胞骨架相联。穿膜区富含疏水氨基酸。β亚单位的胞膜外部分含有4个富含半胱氨酸的重复序列,靠近外侧N端的40~50kD的氨基酸残基通过链内二硫键紧密折叠在一起(图6-1)。
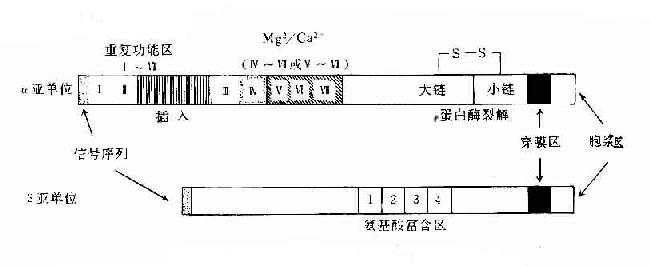
图6-1 粘附分子结构模式图
(二)粘合素分子的组成
目前已知至少有14种α亚单位和8种β亚单位,除α7和αIEL外其它粘附分子亚单位均已基因克隆成功。α亚单位和β亚单位组合构成粘合素分子并不是随机的,多数α亚单位只能与一种β亚单位结合成异源双体,而大部分β亚单位则可以结合数种不同α亚单位。目前按β亚单位的不同可将粘合素超家族分为7个不同的组,在同一组粘合素分子的不同成员中,β链相同,α链不同。已知α链和β链有20种左右的组合形式。表6-3概括了目前常见的粘合素超家族粘附分子β1、β2和β3组的结构及其相应配体。
表6-3 粘合素超家族粘附分子β1、β2、β3组结构及其相应配体
| 分组 | 成员 | α/β亚单位 分子量(kD) | 亚单位 结构 | 分布 | 配体 |
| VLA组 (β1组) | VLA-1 VLA-2 VLA-3 VLA-4 VLA-5 VLA-6 (α7β1) (α8β1) VNR-β1 | 210/13(CD49a/CD29) 165/130(CD49d/CD29) 135+25/130(CD49c/CD29) 150/130(cd49d/CD29) 135+25/130(CD49e/CD29) 120+30/130(CD49f/CD29) (-/CD29) (-/CD29) 150/130 (CD51/CD29) | α1β1 α2β1 α3β1 α4β1 α5β1 α6β1 α7β1 α8β1 αvβ1 | 广泛 广泛 广泛(但未见在淋细胞表面) 淋巴细胞Mo 广泛 广泛 某些细胞系 | CA,LM CA,LM FN,LM,CA FN,VCAM-1 FN LM LM(?) FN,(VN) |
| 白细胞粘 附受体组 (β2) | LFA-1 Mac1/CDR3 P150,95/CR4 | 180/95(CD11b/CD18) 165/95(CD11b/CD18) 150/95(CD11c/CD18) | αLβ2 ΑMβ2 αXβ2 | 白细胞 吞噬细胞大颗粒淋巴细胞 吞噬细胞大颗粒淋巴细胞 某些T细胞 | ICAM-1 ICAM-2,3 ic3b,FB X因子,ICAM-1 FB,ic3b |
| 血小板糖 蛋白组 (β3组) | 9pⅡbⅢa VNR/β3 | 120+25/105(CD51/CD61) 125+24/105(CD51/CD61) | αⅡβ3 αvβ3 | 血小板、巨核细胞、单核细胞、内皮细胞、中性细胞 广泛 | FB,FN,vWF,TSP, VN,FB,vWF,TSP,FN,CA |
注:FN:纤维粘连蛋白:LM:层粘连蛋白;TSP:血栓海绵蛋白;VLA:很晚出现的抗原;CA:胶原蛋白:VN:粘连蛋;FB:血纤维蛋白;vWF:von Witlebrand因子;X因子;Factor X:ICAM-1(2,3),细胞间粘附分子-1(2,3);VCAM-1:血管细胞粘附分子-1。
(三)粘合素分子的分布
粘合素分子在体内分布很广泛,多数粘合素分子可以表达于多种组织、细胞,如VLA组的粘合素分子在体内广泛分布于各种组织、细胞,而多数细胞可同时表达数种不同的粘合素分子。对体外培养哺乳动物来源的细胞系粘合素分子表达进行检测,发现每一种细胞系同时表达2~10种不同的粘合素分子,但不同类型的细胞表达粘合素分子的种类是不同的。某些粘合素分子的表达则具有显著的细胞类型特异性,如gpⅡ/bⅢα(Ⅱb/Ⅲβ)主要表达在巨核细胞和血小板,LAF-1、Mac-1、P150/95只表达在白细胞表面,α6β4特异性表达在上皮细胞。此外,每一种细胞粘合素分子的表达可随其表达细胞分化与生长状态的改变而变化。
(四)粘合素分子识别配体的短肽序列
粘合素分子在与配体结合时所识别的只是配体分子中由数个氨基酸组成的短肽序列。不同的粘合素分子可以识别相同的短肽序列或同一个配体中不同的短肽序列。由于同一短肽序列可以存在于几种不同的配体中,因此,一种粘合素分子可能有几种细胞间质成分做为配体,而每一种细胞间质中的配体也可能被几种不同的粘合素分子所识别。α5β1、αvβ1、αⅡbβ3、αvβ3等粘合素分子,可识别配体分子中的RGD(Arg-Gly-Asp,精氨酸-甘氨酸-天冬氨酸)序列。多种细胞间质成分(包括FN,VN、FB、vWF)都含有RGD序列,它们在体内的分布极为广泛。含有RGD序列的人工合成肽可以抑制上述粘合素分子与配体的结合。
二、免疫球蛋白超家族
在参与细胞间相互识别、相互作用的粘附分子中,有许多分子具有与lgV区或C区相似的折叠结构,其氨基酸组成也有一定的同源性,属于免疫球蛋白超家族(immunogiobulinsuperfamily,IGSF)的成员。免疫球蛋白超家族粘附分子的种类、分布及其配体见表6-4。免疫球蛋白超家族粘附分子的配体多为免疫球蛋白超家族中的粘附分子或粘合素超家族的粘附分子,在这种情况下,相互识别的一对IGSF分子或粘合素免疫球蛋白超家族粘分子实际上是互补配体的关系。
表6-4 免疫球蛋白超家族粘附分子的种类、分布和识别配体
| IGSF粘附分子 | 分布 | 分子量(Kd) | 配体 |
| LFA-2(CD2) | T细胞、胸腺细胞、大颗粒淋巴细胞 | 50 | LFA-3(IGSF) |
| LFA-3(CD58) | 广泛 | 40~65 | LFA-2(IGSF) |
| ICAM-1(CD54) | 白细胞、内皮细胞、某些肿瘤细胞、上皮细胞、肝细胞、平滑肌细胞 | 80~114 | LFA-1(粘合素超家族) |
| ICAM-2(CD102) | 内皮细胞 | 60 | LFA-1(粘合素超家族) |
| ICAM-3(CD50) | T细胞、单核细胞、中性粒细胞 | 140/108 | |
| CD4 | 抑制细胞诱导亚群、辅助细胞诱导亚群 | 55 | MHC-Ⅱ(IGSF) |
| CD8 | 抑制性T细胞/杀伤性T细胞 | 34/34 | MHC-Ⅰ(IGSF) |
| MHC-Ⅰ | 广泛 | 44 | CD8(IGSF) |
| MHC-Ⅱ | B细胞、活化T细胞、活化内皮细胞、巨噬细胞 | 32~34/29~32 | CD4(IGSF) |
| CD28 | T细胞 | 44 | B7/B7(IGSF) |
| B7/B71(CD80) | 活化B细胞、活化单核细胞 | 60 | CD28(IGSF) |
| N-CAM-Ⅰ | 神经元、胚胎细胞 | 97~220 | N-CAM-Ⅰ(IGSF) |
| VCAM-Ⅰ(CD106) | 内皮细胞、上皮细胞、树突细胞、巨噬细胞 | 100,110 | VLA-4粘合素超家族 |
| PECAM-Ⅰ(CD31) | 白细胞、血小板、内皮细胞 | 140 | PECAM-Ⅰ(IGSF) |
注:LFA:淋巴细胞功能相关抗原;ICAM:细胞间粘附分子;VDAM:血管细胞粘附分子;PECAM:血小板内皮细胞粘附分子;N-CAM:神经细胞粘附分子。
三、选择素家庭
选择素(selectin)家庭最初被称为外源凝集素细胞附分子家庭(selectincellabhesion moleculefamily,LEC-CAM家族)。selectin是由select和lectin两词衍生而来,目前国内尚无统一译法,选择素一词似为妥当。
(一)选择素分子的基本结构
选择素分子为穿膜的糖蛋白、可分为胞膜外区、穿膜区和胞浆区。选择素家族各成员胞膜外部分有较高的同源性,结构类似,均由三个功能区构成:①外侧氨基端(约120个氨基酸残基)均为钙离子依赖的外源凝集素功能区(calcium depenednt Icetindomain),可以结合碳水化合物基团,是选择素分子的配体结合部位;②紧邻外源凝集素功能区的表皮生长因子样功能区(epidermal growthfactor like domain, EGF样区),约含35个氨基残,EGF样功能区虽不直接参加与配体的结合,但对维持选择素分子的适当构型是必需的;③靠近膜部分是数个由约60个氨基本酸残基构成的补体结合蛋白(complement bindingprotein)重复序列。各种选择素分子的穿膜区和胞浆没有同源性。选择素分子的胞浆区与细胞内骨架相联。
(二)选择素家族的组成
目前已发现选择素家族中有三个成员:L-选择素、P-选择素和E-选择素,L、P和E分别代表白细胞、血小板和内皮细胞。这三种细胞是最初发现相应选择素分子的细胞,故得名。选择素家族成员的细胞分布和相应配体见表6-5。
| 选择素家族组成 | 分子量(kD) | 分布 | 配体 | 功能 |
| L-选择素(CD62L)(LAM-1,LECAM-1) | 9p75~80 | 白细胞 | CD15s(S-Lewis)在外周淋巴结HEV上PNAd | 白细胞与内皮细胞粘附,向炎症部位游走,淋巴细胞归巢到外周淋巴淋巴结 |
| P-选择素(62P) (GMP-140,PAGEM) | 9p140 | 贮存于巨核细胞、血小板α颗粒和血管内皮细胞,WeibelPalade小体,凝血酶和组胺诱导后表达于细胞表面 | CD15a(S-Lewisx)CD15 | 白细胞与内皮细胞和血小板粘附 |
| E-选择素(CD62E)(ELAM-1) | 9p115 | 细胞因子活化血管内皮细胞 | 中性粒细胞CD15s(S-Lewis)、淋巴细胞上CLA | 白细胞与内皮细胞粘附,向炎症部位游走 |
注:LAM:白细胞粘附分子;ELAM:内皮细胞白细胞粘附分子;LECAM:白细胞内皮细胞粘附分子:PNAd:外周淋巴结定居素;GMP:颗粒蛋白:Slewis;唾液酸化的路易斯寡糖;PADGEM:血小板活化依赖的颗粒外膜蛋白CLA:皮肤淋巴细胞相关抗原
(三)选择素分子识别的配体
与其它粘附分子不同,选择素分子识别的配体都是一些寡糖基团,主要是具有唾液酸化的路易斯寡糖(Sialyl-Lewis)或类似结构的分子。与蛋白质分子抗原不同,直接决定细胞表面某种寡糖表达的因素,主要是与某些特的糖基转移酶或碳水化合物修饰酶的作用有关。这些酶的作用可能与细胞的生长与代谢状态有密切关联。一种寡糖基团可以存在于多种糖蛋白或糖脂分子上,并分布于多种细胞表面,因此选择素分子的配体在体内的分布较为广泛。已发现然白细胞、血管内皮细胞、血管内皮细胞、某些肿瘤细胞表面及血清中某些糖蛋白分子上都存在有选择素分子识别的碳水化合物基因。
四、钙离子依赖的粘附分子家族
最初发现一种介导细胞间相互聚集的粘附分子,在有Ca2+存在时可以抵抗蛋白酶的水解作用。以后又发现另外两种作用和特性与其类似的粘附分子,它们的氨基酸组成也有同源性,因此将其命名为钙离子依赖的粘附分子家族(Ca2+dependent cell adhesion molecule family,Cadherm家族)。钙离子依赖的粘附分子家族的粘附分子对于生长发育过程中细胞的选择性聚集具有至关重要的作用。
(一)Cadheria分子结构
Cadherin分子均为单链糖蛋白,约含723-748个氨基酸残基,不同的Cadherin分子在氨基酸水平上有43%-58%的同源性。Cadherin分子由胞浆区、穿膜区和胞膜外区三部分组成,其胞膜区有数个重复功能区,并含有由3-5个氨基酸残基组成的重复序列。近膜部位含有4个保守的半胱氨酸残基,分子外侧N端的113个氨基酸残基构成Cadherin分子的配体结合部位。此外胞膜外部分具有结合钙离子的作用。Cadherin分子的胞膜内部分高度保守,并与细胞内骨架相连。
(二)Cadherin家庭的组成和分布
目前已知Cadherin家族共有3个成员,E-Cadeherin、N-Cadherin和P-Cadherin。不同的Cadherin分子在体内有其独特的组织分布,它们的表达随细胞生长发育状态的不同而改变。Cadherin分子以其独特的方式相互作用,其配体是自身相同的Cadherin分子。
表6-6 Cadherin家族的组成、分布及其配体
| Cadherin家族成员 | 分子量(kD) | 分布 | 配体 |
| E-Cadherin | 124 | 上皮组织 | E-Cadherin |
| N-Cadherin | 127 | 神经组织、横纹肌、心肌 | N-Cadherin |
| P-Cadherin | 118 | 胎盘、间皮组织、上皮组织 | P-Cadherin |
五、其它未归类的粘附分子
除了上述四为类粘附分子外,还有一些粘附分子目前尚未归类,包括一组作为selectin分子的配体的CD15、CD15s(s-Lewis),此外,还有CD44、MAd、MLA等粘附分子,兹列于表6-7。
粘附分子参与机体许多重要的生理和病理过程,主要包括:①通过表达于白细胞粘附分子CD11a/CD18、CD11b/CD18、CD11c/CD18、VLA-4、L-selectin、CD15、CD15s、和P-selectin相互粘附,参与炎症的发生;②通过表达于淋巴细胞上的归巢(Iymphocyte homingreceptor,LHR)、L-selectin、CLA、LFA-1、VLA-4、CD44、LPAM-2分别与表达于血管内皮细胞上的定居素(addressin)PNAd、E-selectin、ICAM-1、ICAM-2、VCAM-1、MAd、CAM相互粘附使淋巴细胞向外周淋巴器官,皮肤炎症部位或粘膜相关淋巴组织的回归;③通过CD/MHCⅡ类分子非多态部分、CD8/MHC1类分子非多态部分、LFA-1/ICAM-1、LFA-2/LFA-3、CD28/B7的相互作用参与免疫应答中APC呈提抗原、抗原识别、免疫细胞相互协作以及CTL杀伤靶细胞等多个环节;④通过Cadherin、N-CAM、CD31等分子的自身粘附,以及某些粘附分子与细胞外基质的粘附,参与细胞的发育、分化、附着及移动;⑤E-Cadherin、家庭些成员以及CD44分子等与肿瘤的浸润、转移有关;⑥通过血小板表达的粘附分子参与动脉、静脉中血栓形成以及其它形式的凝血过程。
表6-7 尚未归类粘附分子的主要特征
| 种类 | 结构 | 主要分布细胞 | 配体 | 功能 |
| PANd | 50~200kD,含有唾液酸化的寡糖决定簇 | 外周淋巴结高内皮细胞 | L-selectin | 淋巴细胞向淋巴结归位 |
| CLA | 含有唾液酸化的寡糖决定簇 | 记忆T细胞 | E-selectin | 向皮肤炎症部位归位 |
| CD44(ECMRⅢ) | 90~200kD | 广泛分布,在T细胞中主要存在于记忆T细胞 | FN、CA、透明质酸,MAd | 淋巴细胞向炎症部位、粘膜相关淋巴组织归位,粘附ECM |
| MAd | 60kD | 炎症部位血管内皮细胞、粘膜相关淋巴组织 | CD44,LPAM-2 | 淋巴细胞向炎症部位及粘膜相关淋巴组织归位 |
| CD36 | 9p88,血小板 GpⅢb | 血小板髓样细胞、内皮细胞 | CA,TSP? | 血小板粘附 |
注:PANd:外周淋巴结定居素;MAd:粘膜血管定居素;CLA:皮肤淋巴细胞相关抗原:LPAM:淋巴细胞集合淋巴结粘附分子;ECM:细胞外基质。
白细胞、血管内皮细胞或其它细胞表面的粘附分子可脱落下来,进入血液可为可溶性粘附分子(soluble adhesion molecules,sAM)。此外,某些粘附分子的mRNA存在着不同的剪接形式,其中有的mRNA翻译后产物可能不表达在细胞表面,而是直接分泌进入血液,成为可溶性粘附分子的另一个重要来源。在结构上,可溶性粘附分子一般缺少其对应膜结合粘附分子的穿膜和胞浆部分,其分子量也比相应膜结合粘附分子为小。由于可溶性粘附分子通常具有膜结合附分子的结合活性,因此可能作为机体调节细胞粘附作用的一个途径发挥作用。在某些疾病状态下,粘附分子的表达或脱落增加,导致血清中可溶性粘附分子的水平显著升高,使可溶性附分子的检测可能成为监测某些疾病状态的指征。
-
《医学免疫学》 中的相关章节:
……
第三节 MHC分子的功能
第四节 HLA的医学意义
第五节 HLA分型技术
第六章 免疫细胞膜分子(二):白细胞分化抗原
第一节 白细胞分化抗原
第二节 粘附分子(当前页)
第三节 其它免疫细胞膜分子
第七章 免疫细胞(一):造血干细胞
第一节 造血干细胞的特性
第二节 造血干细胞的分化
……