第二节 酸碱滴定法
酸碱滴定法是以酸碱反应为基础的滴定分析方法。利用该方法可以测定一些具有酸碱性的物质,也可以用来测定某些能与酸碱作用的物质。有许多不具有酸碱性的物质,也可通过化学反应产生酸碱,并用酸碱滴定法测定它们的含量。因此,在生产和科研实践中,酸碱滴定法的应用相当广泛。
一、滴定曲线与指示剂的选择
(一)强碱滴定强酸
强碱滴定强酸时发生的反应为
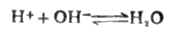
上述反应的平衡常数为Kt为
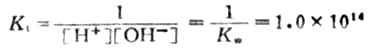
现以0.1000mol·L-1NaOH溶液滴定20.00mL,0.1000mol·L-1HCL.溶为例,讨论滴定过程中溶液pH值的变化情况。
1.滴定前
溶液[H+]等于HCL的初始浓度:
[H+]=c(HCl)=0.100mol.L-1
pH=-lg[H+]=1.00
2.化学计量点前
溶液的[H+]决定于剩余HCL的浓度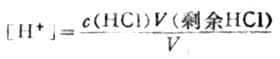
例如,当滴入18.00mLNaOH溶液时,有90%的HCL被中和,剩余HCL物质的量为0.1000×20.00-0.1000×18.00=0.2000mmol,此时溶液的总体积为38.00mL,则溶液的[H+]为:
[H+]=0.2000/38.00=5.3*10-3(mol.L-1)
pH=-lg[H+]=-lg5.3*10-3=2.28
用类似的方法可求得当加入19.98mL NaOH时溶液的PH值为4.30。
3.化学计量点时
当加入20.00mLNaOH溶液时,HCL溶液被100%的中和,变成了中性的NaCL水溶液,故溶液的PH值由水的离解决定。
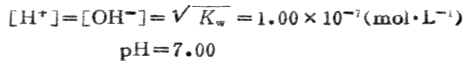
4.化学计量点后
溶液的PH值由过量的NaOH的量和溶液的总体积决定。即
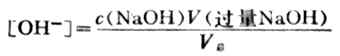
例如,当加入20.02ml NaOH溶液时, NaOH溶液过量0.02ml,溶液的总体积为40.02ml,则溶液的[OH-]为:
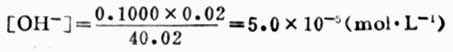
pOH=4.30
pH=14.00-4.30=9.70
根据上述方法可以计算出不同滴定点时溶液的PH值,部分结果列于表7-1。根据表中的数据作图,即可得到强碱滴定强酸的滴定曲线图7-1中的a。
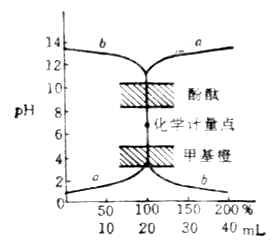
图7-1 NaOH与HCL的滴定曲线
c(NaOH)=c(HCl) =0.1000mol.L-1
图7-1
表7-1 用NaOH滴定HCL时溶液PH的变化(c(NaOh )=c(HCL)=0.1000mol·L-1)
| V(加入NaOH) ml | 被滴定HCL的百分含量% | V(剩余HCL) ml | V(过量NaOH) ml | [H3O+] mol·L-1 | PH |
| 0 | 0 | 20.00 | 1.00×10-1 | 1.00 | |
| 19.00 | 90.00 | 2.00 | 5.26×10-3 | 2.28 | |
| 19.80 | 99.00 | 0.20 | 5.02×10-4 | 3.30 | |
| 19.98 | 99.90 | 0.02 | 5.00×10-5 | 4.30 | |
| 20.00 | 100.00 | 0.00 | 1.00×10-7 | 7.00 | |
| 20.02 | 100.1 | 0.02 | 2.00×10-10 | 9.70 | |
| 20.20 | 101.0 | 0.20 | 2.01×10-11 | 10.70 |
滴定曲线不仅说明了滴定时溶液PH值的变化方向,而且也说明了各个阶段的变化速度。从图中可以看出,曲线自左至右明显分成三段。前段和后段比较平坦。溶液的PH值变化缓慢,中段曲线近乎垂直。在化学计量点附近PH值有一个突变过程。这种PH值突变称之为滴定突跃,突跃所在的PH值范围称为滴定突跃范围(常用化学计量点前后各0.1%的PH范围表示,本例的突跃范围是(4.30-9.70)。
最理想的指示剂应该能恰好在反应的化学计量点发生颜色变化,但在实际工作中很难使指示剂的变色范点和化学计量点完全统一。因此,指示剂的选择主要以滴定的突跃范围为依据,通常选取变色范围全部或部分处在突跃范围内的指示剂滴定终点,这样产生的疑点误差不会超过±0.1%。在上述滴定中,甲基橙(PH3.1-4.4)和酚酞(PH8.0-10.0)的变色范围均有一部分在滴定的突跃范围内,所以都可以用来指示这一滴定疑点此外,甲基红、溴酚蓝和溴百里酚蓝等也可用作这类滴定的指示剂。
滴定突跃的大小与溶液的浓度密切相关。若酸碱浓度均增大10倍,滴定突跃范围将加宽2个PH单位;反之,若酸碱浓度减小10倍,相应的突跃范围将减小2个PH单位。可见浓度愈高突跃范围越大,浓度越低突跃范围越小,如果滴定时所用的酸碱浓度相等并小于2×10-4mol ·L-1,滴定突跃范围就会小于0.4个PH单位,用一般的指示剂就不能准确地指示出终点。故将c≥2×10-4mol ·L-1作为此类滴定能够准确进行的条件。
强酸滴定强碱的滴定曲线如图7-1中的曲线b所示。指示剂的选择及滴定反应用及其滴定条件等与前述滴定相似。
(二)强碱滴定弱酸
在这类滴定反应中,由于强碱完全离解而弱酸(HA)部分离解,故滴定反应及其反应常数Kt可表述为:
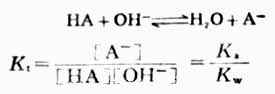
同强碱滴定强酸的反应常数相比较,上述的Kt值要小得多,说明反应的完全程度较前类滴定差。且弱酸的Ka越大,反应的完全程度就越高。
现以0.1000 mol ·L-1NaOH溶液滴定20.00ml0.1000 mol ·L-1HOAc溶液为例讨论这类滴定的特点。
NaOH 滴定HOAc 的滴定曲线如图7-2所示。它和强碱滴定强酸的滴定曲线不同。首先是曲线起始点的PH值为2.87而非1.00。这是由于HOAc 部分离解,其[H+]=√ KaC的结果。其次是起始点至化学计量点前这段曲线先较快地上升,后转入平衡,在临近终点时又较快地上升。这是HOAc –NaOAc缓冲对缓冲作用的表现。在滴定开始后,反应产生的OAc-抑制了HOAc的离解,使得[H+]有较快地下降,PH值上升较明显。当[HOAc]/[ NaOAc]=1时,该缓冲体系的缓冲能力最大,曲线平坦。继续加入NaOH,缓冲能力下降,PH值的上升速度又增加。近化学计量点时几乎无缓冲作用,故PH值上升较快。第三是化学计量点时溶液的PH=8.73,这是NaOAc水解的结果。此外,在化学计量点附近产生的滴定突跃范围明显小于强碱滴定强酸所产生的突跃范围。在化学计量点后,过量的NaOH存在抑制了盐的水解,溶液的PH值由过量的NaOH决定。故滴定曲线与强碱滴定强酸的滴定曲线相似。
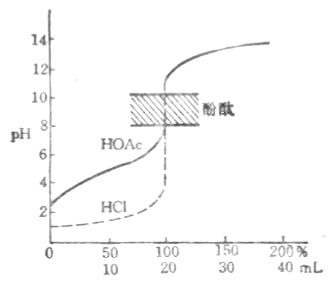
图7-2 用NaOH滴定HOAc的滴定曲线c
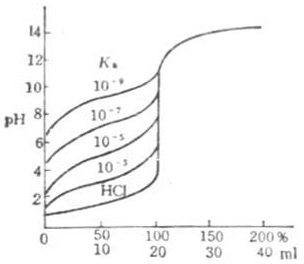
图7-3 NaOH滴定各种不同强并能弱
(NaOH)=c(HOAc)=0.100mol.L-1c(NaOH)=c(HB)=0.1000mol.L-1
根据强碱滴定弱酸时PH值的变化,一般选用变色范围处于碱性范围内的指示剂。较常用的有酚酞和百里酚蓝等。在实际应用时,仍必需依据滴定的突跃范围大小来决定指示剂。
滴定的突跃范围不仅与酸碱浓度有关,还受到弱酸强度的影响。因此在进行此类滴定时必须考虑这两个因素。图7-3是用0.1000mol ·L-1NaOH溶液滴定20.00ml0.1000 mol ·L-1各种不同强度弱酸的滴定曲线.当弱酸的浓度一定时,Ka越大,滴定的突跃范围越大;Ka越小滴定的突跃范围就越小。当c(HB)=0.1000mol ·L-1时,Ka≤10-9,已无明显的滴定突跃,也无法用一般的指示剂确定反应终点。只有当cKa≥10-8时方可用指示剂判别滴滴定突跃(约0.4个PH单位),所以常将c Ka≥10-8作为弱酸能被强碱准确滴定的先决条件。
(三)强酸滴定弱碱
强酸滴定弱碱与强碱滴定弱酸相类似,现以0.1000mol ·L-1HCL溶液滴定20.00ml0.1000 mol ·L-1氨水为例,说明滴定过程中PH值的变化及指示剂的选择.上述滴定的反应和反应常数可表述为:
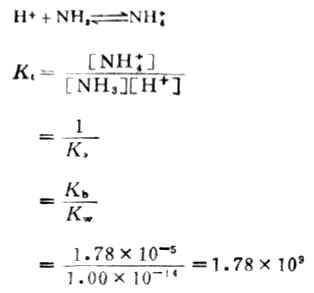
该反应的反应常数较大,可以预计反应能较完全进行.各滴定点PH值可通过计算求得滴定曲线如图7-4。由图可以看出,强酸滴定弱碱时,滴定突跃在酸性范围内,化学计量点时,溶液的PH值小于7.00,对于该例来说,化学计量点时溶液的PH值为5.28,突跃范围是6.25-4.30。对于这种类型滴定所选指示剂的变色范围应在酸性范围内。甲基红或溴甲酚绿是这类滴定中常用的指示剂。
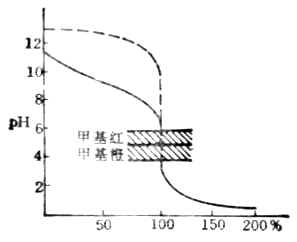
图7-4 用HCl滴定NH3.H2O的滴定曲线c(HCl)=c(NH3.H2O)
=0.1000mol.L-1
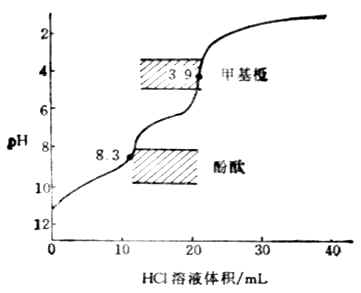
图7-5 HCl滴定Na2CO3的滴定的曲线
在强酸滴定弱碱时,弱碱的Kb值与浓度也应满足cKb≥10-8的条件,方可进行准确滴定。
(四)多元酸盐的滴定
能够用于滴定的多元酸盐一般为强碱弱酸盐,因为它们水解使溶液呈碱性,故可用强酸进行滴定。
Na2CO3是二元弱酸H2CO3的钠盐,由于H2CO3的两级离解常数都很小,CO2-3、HCO-3水解后溶液的碱性足以用HCL直接滴定。因此,常将Na2CO3作为基准物质标定HCL溶液的浓度,工业碱纯度的测定也是基于它与HCL反应。
滴定反应分两步进行,在第一步时Na2CO3全部转变为Na2CO3。
Na2CO3+HCl→NaHCO3+NaCl
所以到达第一化学计量点时,溶液的PH值主要由NaHCO3决定,可按下式计算溶液的酸度:
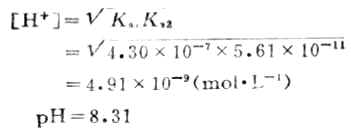
继续用HCL溶液滴定时,发生第二步滴定反应,NaHCO3全部变成H2CO3而达到第二化学计量点:
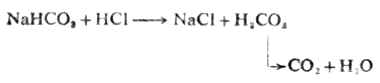
这时的溶液为H2CO3的饱和溶液,在通常的情况下为0.04mol·L-1,则第二化学计量点时溶液的[H+]为:
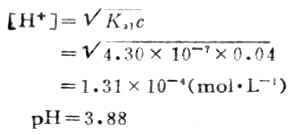
滴定过程中溶液的PH值的变化如图7-5所示。
在PH为8.31和3.88附近各有一个滴定突跃。前一个突跃不大明显,这是由于第一步滴定反应的产物NaHCO3具有一定的缓冲作用以及碳酸的Ka1和Ka2相差不太大的缘故。这步滴定的指示剂常选用酚酞。第二个突跃范围较明显,通常用甲基橙指示剂。终点前溶液中H2CO3能与HCO-3组成缓冲体系,终点不易掌握。故在实际操作时,当反应接近第二化学计量点前,采用加热或不断振摇的办法驱逐溶液中的CO2,这样可以得到较为准确的滴定终点。
二、酸碱滴定法的应用实例
在实际工作中常用的酸溶液主要是HCL溶液,有时也用H2SO4标准溶液。常用的碱溶液是NaOH标准溶液。由于这些试剂价廉易得,加之酸碱滴定法操作简便,分析速度快和结果准确。因而在工农业生产及科学实践中得到广泛应用。在临床检验上常用以测定尿液、胃液及其他体液的酸度。在卫生分析方面也常用以测定各种食品的酸度等。下面介绍一些实例。
(一)食醋中总酸度的测定
食醋约含3%-5%的HOAc,此外,还含有少量其他有机酸。当用NaOH滴定量,所得结果为食醋的总酸度,通常用含量较多的HOAc来表示。滴定反应如下:HOAc+NaOH→NaOHc+H2O
达到化学计量点时溶液显碱性,因此常选酚酞作为指示剂。
操作步骤:用移液管吸取Vml食醋置于250ml容量瓶中,用蒸馏水稀释至刻度,充分摇匀。再用移液管吸出25.00ml放在250ml锥形瓶中,加酚酞指示剂2滴,用NaOH标准溶液滴定,不断振摇,当滴至溶液呈粉红色且在半分钟内不退色即达终点。重复操作2-3次,按下式计算食醋中HOAc的质量分数。
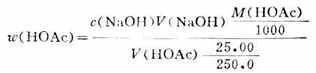
(二)氧化镁含量的测定
因为固体氧化镁难溶于水,所以在测定试样中氧化镁含量(质量分数)时,采用剩余量滴定法。即先称取一定量的待测样品溶于过量且已知准确体积的酸标准溶液中,待反应完全后,用标准碱溶液滴定剩余的酸,反应如下:
MgO+H2SO4(过量)→MgSO4+H2O
2NaOH+H2SO4(乘余) →H2SO4+2H2O
操作步骤:称取约1g(准至0.1mg)左右样品置于锥形瓶中,加入c(H2SO4)=0.5000mol·L-1标准溶液50.00ml,振荡使其溶解,加入甲基橙指示剂2滴,用0.1000mol·L-1NaOH标准溶液滴定剩余的硫酸。当溶液由红变为橙色即为终点。
加入硫酸的总量为:
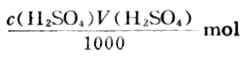
与NaOH反应硫酸的量为:
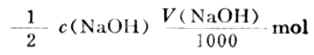
氧化镁的质量分数为:
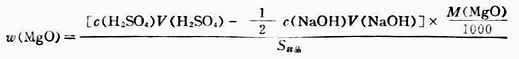
-
《医用化学》 中的相关章节:
……
第一节 氧化还原
第二节 电极电位
第三节 电极电位的应用
第七章 滴定分析
第一节 滴定分析概念
第二节 酸碱滴定法(当前页)
第三节 氧化还原滴定法
第四节 配合滴定法
第八章 比色分析
第一节 比色分析的基本原理
……