幽门螺杆菌尿素酶B基因的克隆、表达及免疫原性研究
世界华人消化杂志 1999年第7期第7卷 研究原著
作者:李明峰 凌 贞 马爱英 赵建华 孙建新 于声芝 吴祥甫
单位:李明峰 凌 贞 马爱英 赵建华 于声芝 解放军455医院消化内科 上海市 200052; 孙建新 吴祥甫 中国科学院上海生物化学研究所 上海市 200031
关键词:螺杆菌,幽门;尿素酶B亚单位;克隆;基因表达;免疫原性
摘 要
目的 应用基因工程方法构建表达幽门螺杆菌尿素酶B亚单位(UreB)的菌株.
方法 用PCR方法从幽门螺杆菌染色体DNA上扩增出UreB基因片段,将其克隆至pSK(+)质粒上,然后插入原核表达载体pET-22b(+)中,在大肠杆菌BL-21(DE3)中表达.
结果 经测序UreB片段有1707bp组成,为编码569个氨基酸残基的多肽. SDS-PAGE和免疫印迹分析检测发现,UreB基因表达的蛋白质分子质量为65000U,并证实该重组蛋白质可以被幽门螺杆菌感染阳性患者的血清所识别,同时将其免疫小鼠可刺激机体产生抗该重组蛋白质的抗体.
结论 重组的UreB可以作为一种有效的蛋白质疫苗用于幽门螺杆菌感染的预防和治疗.
中国图书馆分类号 R573.2
Cloning, expression and
immunogenic of Hp UreB gene
LI Ming-Feng1, LING Zhen1, MA Ai-Ying1, ZHAO Jian-Hua1, SUN Jian-Xin2, YU Sheng-Zhi1 and WU Xiang-Fu2
Department of Gastroenterology, Chinese PLA 455 Hospital, Shanghai 200052, China
Subject headings Helicobacter pylori; urease B; cloning; gene expression; immunogeni
city
Abstract
AIM To construct a recombinant strain which could express antigen of UreB subunit from Helicobacter pylori.
METHODS The gene encoding the structural B subunit of H. pylori urease was amplified from H. pylori chromosomal DNA by PCR. The gene was inserted in the prokaryotic expression vector pET-22b(+), and then was transformed into the BL21(DE3) E.coli strain, expressed UreB recombinant protein.
RESULTS UreB fragments were composed of 1707base pairs, which were encoded polypeptides of 569amino acid residues. Western blot analysis of UreB recombinant protein showed that it can be specifically recognized by the serum of H.pylori-infected patients, and can also be recognized by the serum of immunized Balb/c mice with UreB itself.
CONCLUSION UreB may be an effective protein vaccine for prevention and treatment of the infection of H.pylori.
0 引言
幽门螺杆菌(Helicobacter pylori,Hp)是当今世界上感染率最高的细菌之一,发展中国家和地区尤甚. 它的感染可引起人体产生胃炎和消化性溃疡,与胃癌的发生密切相关[1-3]. Hp在我国普通人群中的感染率较高,约50%~80%, 可经口传播. 与居住条件、人口密度、饮食卫生等因素有关. 如何预防和根除Hp感染是目前临床治疗的重点. 免疫疗法有望成为治疗该类感染性疾病的最有效、最有前景的方法之一[4]. 在Hp的免疫治疗研究方面,应用细菌的超声粉碎抗原、纯化尿素酶(urease, Ure)以及纯化的细胞空泡毒素和热休克蛋白等作为抗原免疫动物均取得了较好的免疫预防和治疗效果[5-7]. 新近研究发现,尿素酶的亚单位UreA和UreB均能诱导机体产生免疫反应,但UreB产生免疫的反应性更强[8,9]. 我们对UreB的目的基因进行了克隆和表达,为Hp疫苗的进一步研究奠定了基础.
1 材料和方法
1.1 材料 细菌株幽门螺杆菌H.pylori ATCC 43504由上海仁济医院消化病研究所萧树东教授惠赠;菌株TG1,BL21(DE3),质粒pSK(+),质粒pET-22b(+)为中科院上海生物化学研究所吴祥甫教授组保存;Balb/c 小鼠购自中科院上海生物化学研究所动物房;T4 DNA连接酶、限制性内切酶、Klenow酶等均购自Gibco BRL公司;Taq DNA聚合酶为MBI公司产品;X-gal,IPTG为Boehringer Mannheim公司产品;羊抗人IgG-辣根过氧化物酶和兔抗鼠IgG碱性磷酸酶均为华美公司产品;患者血清来自解放军455医院内镜室.以患者的胃窦粘膜作尿素酶检测和病理组织切片染色观察是否为Hp感染阳性来筛选血清. 选取Hp感染阳性患者血清10例,正常人血清4例;其余试剂均为进口或国产分析纯.
1.2 方法
1.2.1 总DNA的提取 从固体培养基上刮取适量生长状态良好的Hp菌落,置入100μL无菌去离子水中,制成含菌浓度约为1×1010个/L的菌液,直接加热煮沸2min,离心取上清置-20℃保存备用.
1.2.2 UreB DNA的扩增 取Hp总DNA量2μL,按常规PCR条件进行扩增,即94℃变性5min,加入2U的Taq DNA聚合酶,按如下参数循环35次;94℃变性1min,55℃退火1min,72℃延伸1.5min,最后一个循环结束后72℃反应10min.
1.2.3 重组克隆及DNA序列分析 质粒抽提、酶切反应、电泳鉴定、DNA片段回收、连接反应及细菌转化等均参照文献[10]略加修改进行. DNA测序按自动测序方法进行.
2 结果
2.1 幽门螺杆菌 UreB目的基因 根据Labigne et al[11]报道的UreB DNA序列,经微机分析设计两个引物:P1为5’-GACATATGAAAAAGATTAGCAGAAAAG-3’,P2为5’-GGCTCGAGCTAGAAAATGCTAAAGAGTT-3’. 引物P1为UreB蛋白N端的编码序列,引入起始密码子ATG及Nde I酶切位点;引物P2为UreB蛋白C端编码端的编码序列,引入起始密码子ATG及NdeI酶切位点;引物P2为UreB蛋白C端编码序列的互补序列,并引入一个XhoI酶切位点. 以Hp总DNA为模板进行PCR扩增,产物经1%的琼脂糖凝胶电泳鉴定,可得到一条长约1707bp的DNA扩增产物(图1).

图1 幽门螺杆菌UreB DNA扩增产物的琼质糖凝胶电泳
1. 标准分子质量(1kb DNA ladder). 2. UreB DNA扩增产物
2.2 UreB基因的克隆及序列分析 将PCR产物经Klenow酶补平,与经EcoRV酶切的pSK(+)质粒在T4DNA连接酶作用下,18℃~22℃连接过夜. 然后转化大肠杆菌TG1,通过NdeⅠ和XhoⅠ双酶切鉴定含有插入片段的重组质粒,挑取2个阳性克隆分别进行测序(图2).
NdeI
GACATATGAAAAAGATTAGCAGAAAAGAATATGTTTCTATGTATGGCCCTACTACAGGCGATAAAGTGAGATTGGGCGATACAGACTTGATCG
CTGAAGTA
MetLysLysIleSerArgLysGluTyrValSerMetTyrGlyProThrThrGlyAspLysValArgLeuGlyAspThrAspLeuIleAlaG
luVal
GAACATGACTACACCATTTATGGCGAAGAGCTTAAATTCGGTGGCGGTAAAACCCTAAGAGAAGGCATGAGCCAATCTAACAATCCTAGCAAAG
AAGAACTG
GluHisAspTyrThrIleTyrGlyGluGluLeuLysPheGlyGlyGlyLysThrLeuArgGluGlyMetSerGlnSerAsnAsnProSerLy
sGluGluLeu
GATTTAATCATCACTAACGCTTTAATCGTGGATTACACCGGTATTTATAAAGCGGATATTGGTATTAAAGATGGCAAAATCGCTGGC
ATTGGTAAAGGCGGT
AspLeuIleIleThrAsnAlaLeuIleValAspTyrThrGlyIleTyrLysAlaAspIleGlyIleLysAspGlyLysIleAlaGlyIleG
lyLysGlyGly
AACAAAACTGCTGGTGGTATTGACACACACATCCACTTCATCTCCCCCCAACAAATCCCTACAGCTTTTGCAAGCGGTGTAACAACCATG
ATTGGTGGCGGAAsnLysThrAlaGlyGlyIleAspThrHisIleHisPheIleSerProGlnGlnIleProThrAlaPheA
laSerGlyvalThrThrMetIleGlyGlyGly
**
ACTGGCCCTGCTGATGGCACTAACGCAACCACTATCACTCCAGGCAGAAGAAATTTAAAATTCATGCTCAGAGCGGCTGAAGAATATTCT
ATGAAC TTTGGTThrGlyProAlaAspGlyThrAsnAlaThrThrIleThrProGlyArgArgAsnLeuLysPheMetLeuArgAl
aAlaGluGluTyrSerMetAsnPheGly
*
TTCTTGGCTAAAGGTAACGTTTCTAACGATGCGAGCTTAGCCGATCAAATTGAAGCTGGTGCGATTGGCTTTAAAATCCACGAAG
ACTGGGGTACCACTCCTPheLeuAlaLysGlyAsnValSerAsnAspAlaSerLeuAlaAspGlnIleGlyAlaGlyAlaIle
GlyPheLysIleHisGluAspTrpGlyThrThrPro
*
TCTACAATCAATCATGCGTTAGATGTTGCAGACAAATACGATGTGCAAGTCGCTATCCACACAGACACTTTGAATGAAGCCGGTTGC
GTGGAAGACACTATGSerThrIleAsnHisAlaLeuAspValAlaAspLysTyrAspValGlnValAlaIleHisThrAspThrL
euAsnGluAlaGlyCysValGluAspThrMet
GCAGCCATTGCCGGACGCACTATGCACACTTTCCACACTGAAGGCGCTGGCGGCGGACACGCTCCTGACATTATTAAAGTGGCCGG
TGAACACAACATTCTAAlaAlaIleAlaGlyArgThrMetHisThrPheHisThrGluGlyAlaGlyGlyGlyHisAlaProAspIleIl
eLysValAlaGlyGluHisAsnIleLeu
CCTGCTTCCACTAACCCCACTATCCCTTTCACCGTGAATACAGAAGCCGAACACATGGACATGCTTATGGTGTGCCACCACTTGGATAA
AAGCATTAAAGAAProAlaSerThrAsnProThrIleProPreThrValAsnThrGluAlaGluHisMetAspMetLeuMetValCysHis
HisLeuAspLysSerIleLysGlu
*
GATGTTCAGTTCGCTGATTCAAGGATC GCGCCTCAAACCATTGCGGCTGAAGACACTTTGCATGACATGGGGATTTTCTCAATCA
CCAGTTCTGACTCTCAAAspValGlnPheAlaAspSerArgIleAlaProGlnThrIleAlaAlaGluAspThrLeuHisAspMetGlyIl
ePreSerIleThrSerSerAspSerGln
GCTATGGGTCGTGTGGGTGAAGTTATCACCAGAACTTGGCAAACAGCTGACAAAAACAAAAAAGAATTTGGCCGCTTGAAAGAAGAAAAAG
GCGATAACGACAlaMetGlyArgValGlyGluValIleThrArgThrTrpGlnThrAlaAspLysAsnLysLysGluPheGlyArgLe
uLysGluGluLysGlyAspAsnAsp
AACTTCAGGATCAAACGCTACTTGTCTAAATACACCATTAACCCAGCGATCGCTCATGGGATTAGCGAGTATGTCGGTTCTGTAGAAG
TGGGCAAAGTGGCTAsnPreArgIleLysArgTyrLeuSerLysTyrThrIleAsnProAlaIleAlaHisGlyIleSerGly
TyrValGlySerValGluValGlyLysValAla
GACTTGGTATTGTGGAGTCCAGCATTCTTTGGTGTGAAACCCAACATGATCATCAAAGGCGGATTCATTGCATTGAGTCAAATGG
GTGATGCGAACGCTTCTAspLeuValLeuTrpSerProAlaPhePheGlyValLysProAsnMetIleIleLysGlyGlyPhe
IleAlaLeuSerGlnMetGlyAspAlaAsnAlaSer
* *
AGGGATACCCCACAACCGGTTTATTACAGAGAAATGTTCGCTCATCATGGTAAAGCTAAATACGATGCAAACATCACTTTTGTG
CTCAAGCGGCTTATGACArgAspThrProGlnProValTyrTyrArgGluMetPheAlaHisHisGlyLysAlaLysTyrAsp
AlaAsnIleThrPheValSerGlnAlaAlaTyrAsp
AAAGGCATTAAAGAAGAATTAGGGCTTGAAAGACAAGTGTTGCCGGTAAAAAATTGCAGAAACATCACTAAAAAAGACATG
AATTCAACGACACTACCGCTLysGlyIleLysGluGluLeuGlyLeuGluArgGlnValLeuProValLysAsnCysArgAsn
IleThrLysLysAspMetGlnPheAsnAspThrThrAla
CACATTGAAGTCAATCCTGAAACTTACCATGTGTTCGTGGATGGCAAAGAAGTAACTTCTAAACCAGCCAATAAAGTGAGC
TTGGCGCAACTCTTTAGCATTHisIleGluValAsnProGluThrTyrHisValPreValAspGlyLysGluValThrSer
LysProAlaAsnLysValSerLeuAlaGlnLeuPreSerIle
XhoⅠ
TTCTAGCTCGAGCC
PheAMP
图2 幽门螺杆菌UreB核苷酸及其对应的氨基酸残基序列. *表示对应的氨基酸残基序列与文献报道不同(Labigne et al 1991[11]).
2.3 UreB基因在大肠杆菌中的表达 将克隆至pSK(+)质粒中的UreB基因片段以NdeⅠ和XhoⅠ双酶切,低溶点胶分离纯化后与先行NdeⅠ和XhoⅠ双酶切的表达载体pET-22b(+)相连接,构建大肠杆菌表达质粒pET-UreB(图3),将其表达质粒转化大肠杆菌BL21(DE3),筛选表达株BL-UreB. 将含表达质粒的单克隆菌落在LB培养基(含氨苄青霉素100mg/L)中37℃培养至A600为0.4~0.6时,加入终浓度为1mmol/L的IPTG,诱导表达4h,离心收集菌体,进行SDS-PAGE电泳(图4). 结果发现,经IPTG诱导后高效表达分子量约为65000u的蛋白质,凝胶自动扫描分析,UreB重组蛋白质表达量占菌体总蛋白质的25%左右.
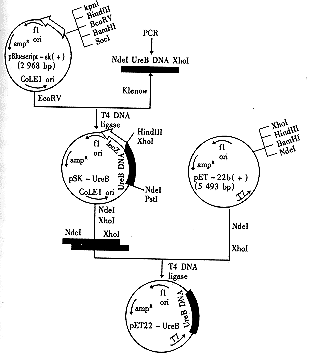
图3 表达质粒pET-UreB的构建.
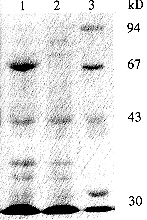
图4 UreB表达蛋白质的SDS-PAGE检测分析.
1. IPTG诱导表达4h;2. 诱导表达前;3. 标准蛋白质分子质量.
2.4 UreB表达的蛋白质的免疫印迹分析 以10%的凝胶作分离胶行聚丙烯凝胶电泳,电泳后将凝胶上的蛋白质电转移至硝酸纤维膜上. 含标准蛋白质的膜用氨基黑染色,其余的膜用100g/L脱脂干奶粉封闭非特异性位点后,用Hp感染阳性患者的血清(1∶100稀释)作为一抗,羊抗人IgG-辣根过氧化物酶(1∶500稀释)作二抗,用含DAB的柠檬酸-磷酸氢二纳缓冲液作为底物显色,同时取正常健康人的血清作阴性对照. 结果发现在分子质量为65000u处有一阳性条带(图5),而正常血清对照处则未显示条带.

图5 幽门螺杆菌UreB重组蛋白质的免疫印迹分析.
1. 用Hp感染阳性患者的血清作一抗检测;2. 用正常健康人血清作对照.
2.5 UreB表达的蛋白质的纯化 由于pET-UreB表达的蛋白质的C端融合了6×His,故表达产物用Ni-NTA树脂纯化. BL-UreB表达菌先经冻融法检测,UreB在菌体胞质内和包含体内均有高表达. 将500mL LB培养基制备的BL-UreB菌体溶于10mL连接缓冲液(20mmol/L Tris-HCl,5mmol/L咪唑,pH 7.0)中,超声将胞膜击碎,8000g离心30min后取沉淀,用含有1mol尿素10mL的连接缓冲液溶解沉淀后直接上预先以3倍体积平衡的Ni-NTA柱. 加10倍柱体积连接缓冲液,再以6倍柱体积的洗涤缓冲液(20mmol/L Tris-HCl, 20mmol/L咪唑,pH 7.9)洗涤,最后以6倍柱体积的洗脱缓冲液(20mmol/L Tris-HCl,300mmol/L咪唑,1mol尿素,pH 7.9)洗脱目的蛋白质,将洗脱液作免疫印迹分析鉴定分离重组蛋白的纯度,结果发现在分子质量约65000u处有一条带,其蛋白纯度约达85%以上(图6).
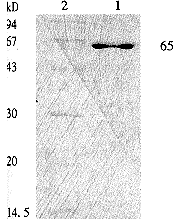
图6 UreB纯化蛋白质的SDS-PAGE分析.
1. 纯化的重组蛋白质UreB;2. 标准蛋白质分子质量
2.6 UreB重组蛋白质的免疫原性分析 选取6~8周龄的♀Balb/c小鼠20只,分为2组,每组10只,分别予以小鼠尾背部皮下注射UreB重组蛋白质和生理盐水. 纯化的UreB经生理盐水透析后制成质量浓度为50mg/L,每次注射200μL,1次/wk共注射4次. 首次免疫加用福氏不完全佐剂,35d后取小鼠眶静脉血作抗体鉴定. 以纯化的重组蛋白质包被96孔平板,小鼠血清(1∶100)作一抗,兔抗鼠IgG-碱性磷酸酶(1∶1000)作二抗行酶联免疫吸附试验检测. 结果发现用UreB重组蛋白质免疫的小鼠血清均可检测到抗UreB的抗体,而生理盐水组的小鼠血清中未检测到该抗体.
3 讨论
尿素酶是螺杆菌属所富含的一种酶,对该菌属在胃内的寄生和致病起重要作用,幽门螺杆菌合成的尿素酶量很大,约占菌体总蛋白的5%,几乎所有的Hp细菌均含有尿素酶. 尿素酶可水解人类代谢的废物,释放氨和二氧化碳,这种一过性的氨产生的低酸和高pH使细菌能够顺利穿过胃粘液层到达粘膜表面,从而达到定植和损伤胃粘膜的目的. 尿素酶含有两个亚单位:UreA和UreB,其基因组包含有9个基因,即UreA, UreB结构基因和一些调节基因. 高亲和力的镍传输蛋白是重组尿素酶活性所必需的[12]. 本实验构建的pET-UreB质粒,其DNA编码序列与文献报道相比,有3.3%(58/1707)的编码碱基发生变异,约有1.2%的(7/569)氨基酸序列不同,同源性高达98%以上. 认为①所采用的Hp的菌种不同;②Hp的菌株间的变异性较大,不同的患者感染的Hp具有其独特的限制性片段长度多态性(RFLP)谱型,尤其是不同地区差别更加明显,通常有好几个片段的差异[13],但其高度同源性又决定了不同的菌株间编码蛋白的主要抗原决定族是一致的.
UreB重组蛋白质能诱发机体产生保护性免疫反应已得到证实[8,9]. 我们在E.coli中表达的重组蛋白UreB,用免疫印迹法证实其蛋白质分子质量为65000u,略大于Suerbaum et al报道的62000u. 其原因主要与重组蛋白的C末端连接了6个甘氨酸有关. 用重组蛋白UreB作为抗原包被平板,经酶联免疫吸附试验检测发现,10例Hp感染阳性患者的血清中有8例与重组蛋白UreB反应阳性,而4例正常人血清与之无交叉反应性. 同时本实验用纯化的重组蛋白UreB免疫Balb/c小鼠,结果观察到,用UreB免疫的小鼠组其全部小鼠血清中均可检测到抗UreB的抗体,而对照组则无. 由此初步认为本实验制备的UreB重组蛋白质可能可以作为疫苗而用于Hp的预防和治疗,关于其免疫保护作用正在进一步研究中.
致谢 本文在撰写过程中承蒙潘伯荣教授的指点,在此表示衷心的感谢.
作者单位:李明峰,男,1966-01-16生,甘肃省张掖市人,汉族. 1989年毕业于第四军医大学六年制本科,1994年第
四军医大学消化学硕士毕业,主治医师,发表论文18篇.
通讯作者 李明峰,200052,上海市淮海西路338号,解放军455医院消化内科.
Correspondence to: Dr. Li Ming-Feng, Department of Gastroenterology, Chinese PLA 455 Hospital, 338 Huaihai Westen Road, Shanghai 200052, China
Tel. +86·21·62811146(H)
4 参考文献
1 Blaser MJ. Epidemiology and pathophysiology of campylobacter pylori infections. Rev Infect Dis,1990;12:99-106
2 Peterson WL. Helicobacter pylori and peptic ulcer diseases. N Engl J Med, 1991;324:1043-1048
3 Parsonnet J, Friedman GD, Vandersteen DP, Chang Y, vogelman JH, Drenterich N, Sibley RK Helicobacter pylori infection and the risk of gastric carcinoma. N Engl J Med, 1991;325:1127-1131
4 Chen MH ,Chen BL. The prospect and actuality on study to Helicobacter pylori vaccine. Weichangbingxue,1996;2:32-34
5 Michett P, crothesy-Theulaz, Davin C, Haas Rvaney Ac, HeiTZ M, Bille Jkraehenbuhl JP, saraga E, Blum AL. Immunization of Balb/c mice against Helicobacter felis infection with H.pylori urease. Gastroenterology, 1994;107:1002-1011
6 Manetti R, massari P, Burroni D, marchini A, Bernard M. Helicobacter pylori cytotoxin: importance of native conformation for induction of neutralicing antibodies. Infect Immun, 1995;11:4476-4480
7 Ferrero RL, Thiberge JM, Kansau I, Wuscher N, Huerre M, Labigne A. The Groes lomologue of Helicobacter pylori confers protective immuninity against mucosal infection in mice. Proc Natl Acad Sci USA, 1995;92:6499-6503
8 Corthesy-Theulaz I, Porta N, Glauser M,Saraga E, Vaney AC. Oral immunization with Helicobacter pylori urease B subunit as a treatment against Helicobacter infection in mice. Gastroenterology, 1995;109:115-121
9 Gomez-Duarte, OG, Lucas,B, Yan ZX, Panthel K, Haas R, Meyer, TF. Protection of mice against gastric colonization by Helicobacter pylori by single oraldose immunization with attenuated salmonella typhimurium producing urease subunits A and B. Vaccine, 1998;16:460-471
10 Sambrook J Fritsch EF, Maniatis T. Molecular Cloning-A Laboratary manual. 2nd ed, New York:Clod Spring Harbor Laboratory Press, 1989
11 Labigne A, Cussac V, Courcoux P. Suttle cloning and nucleotide sequencesof Helicobacter pylori genes responsible for urease activity. J Bacteriol, 1991;173:1920-1931
12 Kansua I, Gullani F, Thiberge JM, Labigne A. Nickle binding and immunological propertis of the C-terminal domain of the Helicobacter pylori GroEs homologue(HspA). Mol Microbiol, 1996;14:947-959
13 Langenberg W, Rauws EAJ, Widjojokusumo A, Tytgat GNJ, Zanen HC. Identification of campylobacter pylori isolates by restriction endonuclease DNA analysis. J Clin Microbiol, 1986;24:414-417
收稿日期 1999-04-15