胃癌、大肠癌与端粒酶活性及DNA倍体的关系
癌症 2000年第1期第19卷 基础研究
作者:张雁 贾汝梅 张玉印 王凤安 宋伟庆 闫庆辉 庄甲举
单位:张雁 贾汝梅 张玉印 王凤安 宋伟庆 闫庆辉(河北医科大学附属第二医院胃肠外科,河北石家庄050000);庄甲举(解放军石家庄医学高等专科学校,河北石家庄050000)
关键词:胃癌;大肠癌;端粒酶;聚合酶链反应;流式细胞术
摘 要:目的:研究胃、大肠癌与端粒酶表达活性及DNA倍体的关系。方法:端粒重复扩增—酶联免疫吸附法(TRAPELISA法)检测肿瘤及无瘤残端粘膜端粒酶活性,流式细胞术检测肿瘤的DNA倍体。结果:肿瘤瘤体端粒酶阳性者占84.0%(42/50),无瘤残端酶阳性者占2.0%(1/50);端粒酶阳性肿瘤中异倍体肿瘤占52.38%(22/42),而端粒酶阴性肿瘤无异倍体出现;端粒酶阳性瘤体平均直径6.5cm,阴性瘤体平均直径3.9cm;端粒酶阳性肿瘤淋巴转移率为59.5%(25/42),阴性者转移率为12.5%(1/8),四者差别均有显著意义,P值分别为:P<0.005,P<0.05,P<0.002,P<0.05。结论:胃癌及大肠癌端粒酶活性升高,酶阳性肿瘤异倍体发生率高,且瘤体大,淋巴转移率高,说明端粒酶的激活在恶性肿瘤的发生发展中是重要因素,并且与疾病的进程相关。
分类号:R735.2;R735.3 文献标识码:A
文章编号:1000-467X(2000)01-0042-03
Telomerase activity and DNA ploidy in gastric cancer
and colorectal cancer
ZHANG Yan, JIA Ru-mei, ZHANG Yu-yin, et al.
(Second Hospital of Hebei Medical University,Shijiazhuang 050000, P.R.China )
Abstract:Objectives:To study the relation between telomerase activity or DNA ploridy and progression of gastric cancer and colorectal cancer.Methods:Telomerase activity was detected using telomeric repeat amplification protocal-enzyme linked immunosorbent assay(TRAP-ELISA). The DNA content was detected using flow cytometry.Results:Most of the carcinomas (42/50) were telomerase positive, but the telomerase activity was observed infrequently in adjacent mucosa (1/50) (P<0.005). In this study, the aneuploid carcinomas were 52.38% (22/42) in telomerase-positive group, but there were no aneuploid carcinoma in telomerase-negative gronp, (P< 0.05). The mean diameter of telomerase-positive carcinomas was 6.5 cm, but the diameter of telomerase-negative carcinomas was 3.9 cm (P< 0.002). The percentage of lymph node metastasis in telomerase-positive carcinomas (25/42) was higher than that in telomerase-negative carcinomas (1/8), P< 0.05.Conclusions:Telomerase is important in the carcinogenesis of gastric cancer and colorectal cancer, and it is correlated with the progression of the diseases.
Key words: Gastric cancer; Colorectal cancer; Telomerase; Polymerase chain reaction; Flow cytometry ▲
近年来对恶性肿瘤发病机制的研究越来越深入,其与染色体的畸变、原癌基因的激活、抑癌基因的突变等有密切联系。我们研究发现胃癌、大肠癌的发生与端粒酶激活关系密切,提示端粒酶在消化道肿瘤的发生、发展中起重要作用。
1材料与方法
1.1材料
本实验共取标本50例,为1998年2月~1998年9月就诊于河北医大附属二院的病人,其中胃癌30例,年龄40~71岁,男∶女为22∶8。大肠癌20例,年龄24~70岁。男∶女为12∶8。所有病例均经病理证实为癌,接受手术治疗。手术切除标本后立即取材,投入冰盒。用于端粒酶检测的标本半小时内置于-80℃冰箱保存;用于DNA倍体分析的标本用70%酒精固定,4℃冰箱保存。所取标本均在一个月内检测。用于端粒酶检测的试剂为德国宝灵曼公司Telomerase PCRELISA试剂盒提供,PCR循环仪为美国PE公司产品,型号480。流式细胞仪为B.D公司FACSCalibur。
1.2方法
1.2.1端粒酶检测:采用TRAP-ELISA方法,具体步骤如下:取2mm3标本加裂解液60μl,剪碎,0℃静置30分钟后于15000prm4℃离心20分钟,取上清液5μl(紫外分光光度法测定蛋白含量约50μg),PCR循环混合物25μl(扩增引物为biotin标记)蒸馏水20μl进行PCR扩增:循环1∶10min,25℃;循环2:5min,94℃;循环3~32:30s94℃,30s50℃,90s72℃;循环33:10min,72℃。PCR循环产物5μl,变性液20μl混匀,常温放置10min,加杂交液225μl(杂交探针为DIG标记)。取混合物100μl加入MTP板(已包被biotin抗体)常温静置2小时。洗板后,加入抗DIG-POD抗体室温静置30分钟,洗板,再加入POD底物100μl,反应15分钟加终止液,于30分钟内用酶标仪读取吸光度值(OD)。(450nm为检测波长,960nm为参考波长)。当OD≤0.200为阴性,0.200<OD≤0.500为+,0.500<OD≤1.000为++,OD>1.000为+++。
1.2.2DNA倍体检测:将5mm3标本在120目钢网上网搓研磨成细胞悬液,100转/分常温离心5分钟弃上清液,加入0.5%胃蛋白酶2ml37℃消化30分钟,300目尼龙网过滤,1000转/分离心5分钟后弃上清,加入70%酒精3ml于4℃冰箱过夜。采用Bio-Rad公司提供的DNA INDEX AND CELL CYCLE EVALUATION试剂盒,用一步法进行DNA倍体的检测,DNA指数(DI)在0.9~1.1者为二倍体,不在此范围者为异倍体。
1.2.3统计学处理:分别采用χ2检验,t检验和秩和检验,具体统计学方法见文中诸表。
2结果
胃癌及大肠癌均为恶性肿瘤,有无限增殖的特性,经检测瘤体的端粒酶阳性率为84.0%,+++者为13例,++者为10例,+者为19例,无瘤残端阳性率为2.0%,且为弱阳性,瘤体及残端的阳性率有显著差异,P<0.005(见表1)。说明端粒酶激活在消化道肿瘤中是一种普遍现象。
表1 瘤体及无瘤残端端粒酶活性比较
| 部位 |
检测例数 |
阴性(%) |
阳性(%) |
| 瘤体 |
50 |
8(16.0) |
42(84.0) |
| 残端 |
50 |
49(98.0) |
1(2.0) |
统计学处理:采用校正χ2检验P<0.05 端粒酶活性及肿瘤临床特征的关系见表2,酶活性与病人的年龄、性别及肿瘤的大体分型和病理分型无关,而瘤体大小、淋巴转移影响着酶活性。端粒酶阳性的肿瘤平均直径为6.5cm,较酶阴性的肿瘤平均直径3.9cm为大(P<0.002),端粒酶阳性肿瘤淋巴转移率为59.5%,明显高于端粒酶阴性(12.5%)的肿瘤(P<0.05)。
表2 端粒酶活性与肿瘤临床特征的关系
| 临床特征 |
阴性 |
阳性 |
P值 |
| 1平均年龄 |
54.00±10.52 |
56.66±9.43 |
>0.05 |
| 2性别(男:女) |
5:3 |
29:13 |
>0.05 |
| 3瘤体平均直径(cm) |
3.9±1.4 |
6.5±2.4 |
<0.002 |
| 4淋巴转移(例) |
1 |
25 |
<0.05 |
| 5大体分型(例) |
|
| 溃疡型 |
7 |
33 |
>0.05 |
| 浸润型 |
1 |
6 |
| 肿块型 |
0 |
3 |
| 6组织学分型(例) |
|
| 腺癌 |
5 |
19 |
>0.05 |
| 粘液腺癌 |
1 |
11 |
| 低分化癌 |
2 |
12 |
统计学处理:1、3项采用t检验分析;2、4项采用校正χ2
检验;5、6采用秩和检验的正态近似法 同时我们用流式细胞术测定了标本的DNA含量(见表3),端粒酶阳性肿瘤异倍体占52.38%,阴性者均为二倍体,端粒酶阳性肿瘤异倍体比例明显升高(P<0.05),流式细胞术测定DNA标本倍体,结果见图1~5。
表3 端粒酶活性与细胞DNA倍体关系
| 反应 |
检测例数 |
异倍体 |
二倍体 |
| 阳性 |
42 |
22 |
20 |
| 阴性 |
8 |
0 |
8 |
统计学处理:采用χ2检验P<0.005
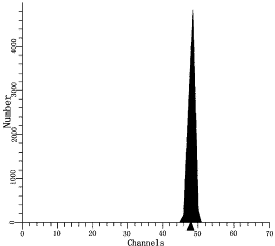
图1正常人血DNA倍体图
DI=1.00;S=0.00%;CV=1.44
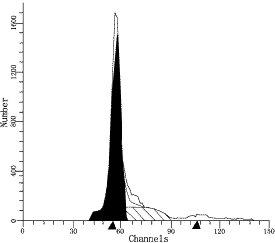
图2胃癌标本DNA倍体图(二倍体)
DI=1.07;S=25.85%;CV=4.57
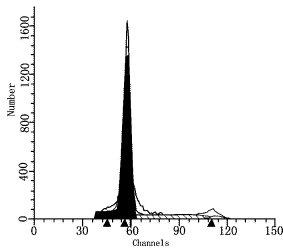
图3结肠癌标本DNA倍体图(二倍体)
DI=1.08;S=18.13%;CV=4.03
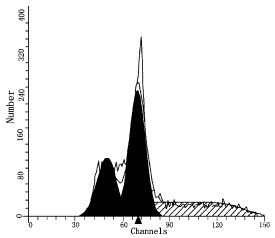
图4胃癌标本DNA倍体图(异倍体)
整倍体峰:DI=0.98;S=0.00%;CV=11.74
异倍体峰:DI=1.38;S=37.68%;CV=7.62
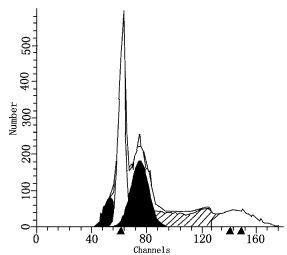
图5直肠癌标本DNA倍体图(异倍体)
整倍体峰∶DI=1.03;S=0.00%;CV=7.42
异倍体峰1∶DI=1.24;S=43.58%;CV=4.13
异倍体峰2∶DI=1.50;S=0.00%;CV=8.31
3讨论
端粒是染色体末端的一段特殊序列,由DNA及蛋白质组成[1]。端粒的存在使染色体末端保持稳定。由于DNA聚合酶不能复制端粒,所以其随细胞分裂而缩短,当缩短到一定程度后细胞将死亡。细胞中存在一种特殊的酶——端粒酶能延长端粒[2],使细胞成为永生化细胞。正常体细胞中端粒酶无活性,随着有丝分裂次数的增加,端粒逐渐缩短,细胞先后经历M1期、M2期后由于端粒极度缩短,染色体出现各种异常形态,绝大部分细胞将死亡,极少数细胞激活了端粒酶,端粒不再缩短,成为永生化细胞,这就是肿瘤发生的“端粒端粒酶学说”[3]。Monika等[4]检测了正常结肠粘膜50例、结肠炎10例、结肠腺瘤20例、结肠癌50例,端粒酶阳性率分别为0%、40%、60%、90%。Hiyama等[5]检测66例胃癌及残端端粒酶活性,早期胃癌的阳性率为82%(14/17),中晚期阳性率为86%(42/49),残端阳性率为6%(4/66),且端粒酶阳性的肿瘤瘤体大、淋巴转移率高、预后差。本实验中胃癌端粒酶阳性率为83.3%,大肠癌为85%,非瘤残端阳性率为2.0%。同时我们的检测也表明:端粒酶活性与病人年龄、性别、肿瘤的大体及病理分型无关,而与瘤体的大小及淋巴转移率有明显关系,与上述文献报道相符。以上这些研究结果显示:端粒酶活性升高在胃癌和大肠癌中是一种普遍现象,并且可以在癌前病变组织中检测到。随着病变的进展其阳性率升高,与疾病进程相关。端粒酶阳性者肿瘤淋巴转移率升高,与恶性肿瘤生物学行为有密切联系。端粒酶可以作为胃肠道肿瘤诊断的有力标志物。
检测中我们发现一例胃癌残端为端粒酶阳性,病理检测为粘膜重度炎症伴不典型增生。该例残端酶阳性的原因为:(1)残端组织重度炎症,大量淋巴细胞浸润,而淋巴细胞有微弱的端粒酶活性[6],所以炎症反应极重的组织可能端粒酶会呈弱阳性;(2)残端组织含微转移灶所致:病理往往仅能通过光镜检测一个平面有无癌转移,端粒酶检测则是测定立体团块细胞的酶活性,比光镜更全面,更易发现肿瘤微转移灶;(3)癌前病变也可导致端粒酶阳性表达[7]。该残端阳性的病例为重度肠上皮化生,可导致端粒酶阳性表达。
在端粒酶激活过程中,端粒将缩短,端粒的主要功能之一是维持染色体的稳定性,防止染色体相互融合及降解。当端粒缩短到一定程度而不能维持其功能,染色体就会发生畸变,形成双着丝粒染色体、环行染色体及染色体缺失等[8],此时细胞便表现为异倍体。同时这些极短的端粒也会激活端粒酶,所以端粒酶阳性的细胞异倍体比例较高。本实验中酶阳性者异倍体占52.4%,而阴性者无异倍体出现。日本学者Okusa等[9]的研究结果与我们相似,认为异倍体肿瘤的端粒酶活性高于整倍体肿瘤。异倍体肿瘤染色体发生畸变,恶性程度高,转移率高,预后差。因而,端粒酶活性可以反应肿瘤的恶性潜能,与病人预后相关。
总之,胃癌及大肠癌端粒酶活性升高,端粒酶阳性肿瘤较阴性者瘤体大、淋巴转移率高、异倍体含量高、预后差。所有这些结果均表明:端粒酶激活在恶性肿瘤进程中是重要因素,端粒酶检测可为临床肿瘤预后判断提供有用信息。
基金项目:本课题受河北省卫生厅基金(98002号)资助
*通讯作者:Tel:86-311-7046901-6831
Email:meakyzdgm@163.net
参考文献:
[1]M ller HJ. The remarking of chromosomes [J]. Woods Hole,1938,13: 181.
ller HJ. The remarking of chromosomes [J]. Woods Hole,1938,13: 181.
[2]Greider CW, Blackburn EH. Identification of a specific telomere terminal transferase activity in Tetrahymena extracts [J]. Cell,1985,43: 405~ 413.
[3]Rhyu MS. Telomeres, telomerase and immortality [J]. J Natl Cancer Inst,1995,87: 884~ 894.
[4]Engelhardt M,Drullinsky P, Guillem J, et al.Telomerase and telomere length in the development and progression of premalignant lesion to colorectal cancer [J]. Clin Cancer Res,1997,3: 1931~ 1941.
[5]Hiyama E, Yokoyama T, Tatsumoto N,et al. Telomerase activity in gastric cancer [J]. Cancer Res,1995,55: 3258~ 3262.
[6]Hiyama K, Hirai YK, Kyoizumi SS, et al. Activation of telomerase in human lymphocytes and hematopoietic progenitor cell [J]. Jimmunol, 1995,155: 3711~ 3715.
[7]Yashima K, Litzky LA, Kaiser L, et al. Telomerase expression in respiratory epithelium during the multistage pathogenesis of lung carcinoma [J]. Cancer Res, 1997,57: 2373.
[8] Blackbur n EH. Structure and function of telomeres [J]. Nature,1991,350: 569.
收稿日期:1999-03-16
修回日期:1999-04-23