白血病抑制因子受体与白血病细胞HL-60内有丝分裂原活化蛋白激酶的关系
第二军医大学学报2000年第21卷第6期
刘厚奇 单继宽 汤淑萍 刘善荣 冀凯宏
摘 要 目的:探讨人白血病细胞系HL-60白血病抑制因子(LIF)受体α亚基(gp190)和另一亚基(gp130)的细胞内区与有丝分裂原活化蛋白激酶(MAPK)的关系,了解LIF受体在调节白血病细胞增殖和分化中的意义。方法:用基因重组技术将两基因细胞内区互换以构成两嵌合体受体(190/130,130/190)并分别在HL-60表达,其与野生型受体竞争性结合LIF,用免疫组化和蛋白质印迹法分析受体细胞内区形成同源性二聚体(190cyt-190cyt,130cyt-130cyt)后的HL-60细胞内MAPK p42/p44的Thr202/Tyr204磷酸化状况。结果:转染pED190/130后用LIF作用10 min后,HL-60细胞MAPK p42/p44 的Thr202/Tyr204磷酸化增加,细胞增殖明显;而另一嵌合体受体与α亚基形成190cyt-190cyt时 hL-60细胞MAPK的磷酸化降低。 结论: LIFR中gp130亚基的细胞内区参与了MAPK的激活及白血病细胞HL-60增殖信号的传递。
关键词;白血病;抑制因子,免疫;受体;HL-60;有丝分裂原;蛋白激酶类
白血病抑制因子(LIF)可抑制白血病细胞,如U937,HL-60,M1等的增殖[1],其效应有赖于结合靶细胞膜上的LIF受体α亚基(gp190),并使之与另一亚基(gp130)形成异源性二聚体[2],从而使细胞内信号分子磷酸化或脱磷酸化[3] ,以调控细胞内DNA合成和细胞分裂速度。研究进一步证实LIF受体与有丝分裂原活化蛋白激酶(MAPK)关系密切[4]。然而,LIF受体哪一亚基影响MAPK的活性?还有哪些分子参与?目前仍不清楚。本研究以人白血病细胞HL-60为靶细胞,将改变后的LIF受体装配在细胞膜上。通过检测细胞内MAPK的表达以及其酪氨酸磷酸化水平,判断LIF受体两亚基与MAPK的关系和各自在HL-60细胞内调节细胞增殖的作用。
1 材料和方法
1.1 细胞 人HL-60细胞株由中科院上海细胞所提供,该细胞株用含10%小牛血清的DMEM(Gibco)37℃,5% CO2 条件下培养。
1.2 LIF受体两亚基细胞内区的互换 以pKCSRα gp190 (LIF 受体α亚基)和pRclgo gp130(Moreau博士提供)为模板,分别以SalⅠ,BamHⅠ和SalⅠ/XhoⅠ,XbaⅠ酶切并装入pALTER。合成引物1:5′-CCATTCTCGTTTTCTAGAGCAAAGGAT-3′和引物2:5′-GTCTCGCTTTCTAGAGCAGAACAGCAC-3′;并用Altered Sites Ⅱ突变系统(Promega)分别使两亚基的跨膜区与细胞内区之间产生XbaⅠ酶切位点。然后,用XbaⅠ和BamHⅠ取下各自细胞内区,并进行互换成190/130和130/190。最后以PstⅠ,EcoR Ⅰ及 Pst Ⅰ,Sma Ⅰ将两亚基嵌合体从pALTER移至表达载体pED(Moreau博士提供)。
1.3 LIF受体两亚基嵌合体基因的HL-60细胞转染 含190/130,130/190嵌合体基因的反转录病毒载体pED(pED190/130,pED 130/190) 用脂质体转染法(Gibco-BRL公司的LipofectamineTM和操作步骤)分别转染于HL-60。72 h后加入LIF[5] 100~250 μg/ml反应10 min,4℃离心,收集细胞置于冰上。
1.4 免疫组化检测MAPK的磷酸化水平 用冷冻PBS将细胞洗两次,接着浸入4%甲醛中固定30 min,均匀涂布于覆有铬明矾明胶的载玻片上,37℃过夜。检测前将涂有细胞的载玻片重新固定20 min,然后用PBS洗3次。滴加正常羊血清封闭20 min,抗p42/p44 MAPK(Thr202/Tyr204)磷酸化的单克隆抗体(Pharmagene)37℃反应40 min ,AKP标记兔抗鼠IgG(Promega)在同等条件下与细胞孵育。随后浸泡于碱性磷酸酶缓冲液(pH9.5)5 min并用 BCIP/NBT使之显色。显微镜观察细胞显色适当后用自来水冲洗、烘干、中性树胶封片。生物显微图像分析系统(复日,FR-988 smartScape 2000)摄相、标记、分析。
1.5 蛋白质印迹法分析MAPK的磷酸化状况 用冷冻PBS将细胞洗两次,然后按1×107个/ml细胞密度加100μl TBS(pH 7.4, 20 mmol/L Tris -HCl, 150 mmol/L NaCl, 1 mmol/L EDTA)含1% triton X-100, 200 μmol/L PMSF(Sigma), 2 μmol/L Leupeptin, 2 μmol/L aprotinine(华顺试剂)在冰上反应20 min后,4℃离心 12 000 r/min×20 min。 上清走12% SDS-PAGE凝胶电泳,用槽式转膜仪(TE52X Pharmacia biotech)将蛋白转移到PVDF(Whatman)。抗p42/p44 MAPK磷酸化单克隆抗体与膜蛋白结合,AKP标记的抗鼠IgG与一抗结合,BCIP/NBT作为酶底物显色。
1.6 统计学处理 用t检验处理各组MAPK磷酸化变化的数据。
2 结 果
2.1 LIF受体嵌合体190/130,130/190的制备 用Altered Sites Ⅱ突变系统按设计在gp190,gp130的跨膜区和细胞内区间产生的限制性内切酶位点经XbaⅠ酶切证实,两亚基的细胞外区跨膜区及细胞内区基因分别用全自动DNA测序仪(ABI pRISM 373A)分析均正确无误。
2.2 LIF受体嵌合体190/130,130/190的转染 用脂质体将pED190/130,pED130/190分别转染于HL-60细胞,经共转染 pEGFP-N1 (Clontech)后3 d并用荧光显微镜观察GFP的表达,60%~70%的细胞为阳性,蛋白质印迹法证实嵌合体转染成功[6]。
2.3 免疫组化检测MAPK磷酸化 加入100~250 ng/ml LIF与细胞表面的野生型LIF受体亚基和嵌合体130/190,190/130结合而分别形成二聚体(190cyt-190cyt,130cyt-130cyt),观察各组细胞内MAPK的磷酸化水平。结果发现MAPK磷酸化水平190/130组较对照组为高(P<0.01),而130/190组则较低(P<0.05,图1)。LIF作用不同时间(0~30 min)后,野生型细胞内MAPK磷酸化水平持续下降;190/130组5 min起MAPK磷酸化水平上升,10 min 达到顶峰;同时130/190组10 min起MAPK磷酸化水平下降,15~20 min 下降最为明显(图2)。实验证明,LIF 可诱导HL-60细胞内MAPK磷酸化下降,而gp130细胞内区形成二聚体时可激活MAPK,另一亚基gp190则反之。所以,LIF的这种效应主要是由gp190介导的。
2.4 蛋白质印迹法分析MAPK的活性 用LIF作用于转染有各嵌合体的细胞,10~15 min后快速冷冻处理后,随即电泳、转膜、印记。结果表明,190/130组的染色条带较对照组和130/190组深(图3)。实验证明,130细胞内区形成同源性二聚体后可诱导MAPK的激活。
2.5 细胞数量 用LIF作用于转染嵌合体190/130的细胞, 72 h后计数,190/130组细胞数量较对照组增加87%(P<0.001),而130/190组与对照组相比无差异。结果表明,gp130细胞内区参与了细胞增殖信号的传递。

图 1 p42/p44 MAPK磷酸化水平
fig 1 p42/p44 MAPK phosphorylation level
P<0.05, P<0.01 vs wild type
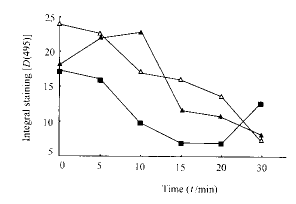
图 2 LIF作用不同时间后细胞内
mAPK磷酸化水平的变化
fig 2 Various MAPK phosphorylation level in
hL-60 induced by LIF at various time△: Wild type; ▲: 190/130; ■: 130/190
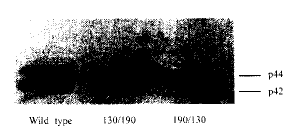
图 3 蛋白质印迹法分析HL-60细胞内
mAPK p42/p44磷酸化活性
fig 3 MAPK p42/p44 phosphorylation activity in
hL-60 detected by Western blotting
3 讨 论
LIF的生物效应是通过结合靶细胞上的LIF受体α亚基(gp190),并使之与IL-6信号传导子(gp130)形成异源性二聚体,从而启动细胞内一系列信号分子的活性以完成LIF的信息从细胞膜至细胞核的传递,使细胞产生一系列生理或病理的变化[3]。虽然受体本身不存在蛋白激酶区域(即谓之非受体酪氨酸激酶受体家族),但是,二聚体形成结构的变化使JAK能够将LIF受体两亚基上的Tyr磷酸化。随之形成“瀑布”效应,包括 sTATS, MAPK,以及磷酸酶的相互诱导和调节,最终使细胞增殖和分化。
有关LIF受体与MAPK的关系,早在1994年被Schiemann 等[4]证实,并发现小鼠3T3-L1细胞内的MAPK 是以LIF 受体α亚基的Ser-1044为反应底物[7]。近来,他又开展了受体截断法和与其他生长激素受体细胞外区形成嵌合体受体的方法,在COS-7细胞中研究gp190,gp130细胞内区与细胞内MAPK的关系,认为gp190和gp130均参与MAPK的激活,可被磷酸化位点分别为Tyr118和Tyr115[8]。
HL-60细胞为人早幼粒细胞白血病细胞,其表面存在LIF受体,LIF刺激后可抑制该细胞的增殖[9]。本研究着眼于了解白血病的发病机制,利用人白血病系HL-60细胞作为靶细胞,研究转染190/130,130/190后的细胞生长状态以及细胞内MAPK的活性变化。此设计是利用LIF作用于细胞膜上受体,以HL-60表达的190/130或130/190分别同野生型的gp190或gp130竞争性结合LIF,从而分析两亚基细胞内区形成同源性二聚体时对HL-60细胞的影响,强调在白血病细胞原条件(生长环境和细胞内信号分子)不变的前提下,外来嵌合受体对细胞生长的干预作用。结果表明,LIF作用于HL-60细胞野生型LIF受体,细胞增殖受到抑制(结果未列出);LIF作用于转染190/130的HL-60细胞,细胞增殖不受抑制,MAPK磷酸化增加,而130/190组MAPK磷酸化下降。因此,我们认为,gp130的细胞内区与MAPK的激活有关。
MAPK在细胞内的信号传导作用是将上游信号(MEK,Raf-1)传到核膜。作用原理是在p42和p44 的Thr202,Tyr204同时被磷酸化后与一锚蛋白(可特异性与核膜结合)结合在一起[10],进而激活c-fos的转录,主要促进细胞的DNA合成以及细胞的分裂,使得细胞不断增殖[11]。130细胞内区形成同源性二聚体时较强地激活MAPK表明,其信号途径有别于LIF受体α亚基[12],各自在调节细胞增殖和分化中发挥作用。
【基金项目】国家自然科学基金资助项目(39680012)
【作者简介】刘厚奇(1957~),男(汉族),副教授,硕士生导师【作者单位】刘厚奇(第二军医大学基础医学部组织胚胎学教研室,上海200433)
单继宽(第二军医大学基础医学部组织胚胎学教研室,上海200433)
汤淑萍(第二军医大学基础医学部组织胚胎学教研室,上海200433)
刘善荣(第二军医大学基础医学部组织胚胎学教研室,上海200433)
冀凯宏(第二军医大学基础医学部组织胚胎学教研室,上海200433)
参考文献
[1] Metcalf d. The leukemia inhibitory factor[J]. Intern J Cell Cloning, 1991, 9(2):95-108.
[2] Gearing DP, Thut CJ, VandaBos T, et al. Leukemia inhibitory factor receptor is structurally related to the IL-6 signal transducer gp130[J]. eMBO J, 1991,10(10):2839-2848.
[3] 刘厚奇,傅继梁.造血因子受体家族的分子结构与细胞内信息传导[J].国外医学*分子生物学分册,1997,19(1):1-7.
[4] Schiemann WP, Nathanson NM. Involvement of protein kinase C during activation of the mitogen-activated protein kinase cascade by leukemia inhibitory factor. Evidence for participation of multiple signaling pathways[J]. j Biol Chem,1994 ,269(9): 6376-6382.
[5] Zhu K, Liu H, Liu XP, et al. Cloning and expression of leukemia inhibitory factor in CHO cell line and its inhibitory effect on the proliferation of U937[J]. J Exp Hematol, 1998,6(2):190-193.
[6] 刘厚奇,汤淑萍,刘善荣,等.白血病抑制因子受体中gp130细胞内区诱导白血病细胞Meg-01内c-myc的表达[J].第二军医大学学报,2000,21(6):522-525.
[7] Schiemann WP, Graves LM,Baumamann H, et al. Phosphoryaltion of the human leukemia inhibitory factor (LIF) receptor by mitogen-activated protein kinase and the regulation of LIF receptor function by heterologous receptor activation[J]. Proc Natl Acad Sci USA, 1995,92 (23) : 5361-5365.
[8] Schiemann WP, Bartoe JL.Box 3-independent signaling mechanisms are involved in leukemia inhibitory factor receptor α-and gp130-mediated stimualtion of mitogen-activated protein kinase[J]. J Biol Chem, 1997,272(26):16631-16636.
[9] Maekawa T, Metcaff D. Colonial suppression of HL-60 and U937 cells by recombinant leukemia inhibitory factor in combination with GM-CSF or G-CSF[J].Leukemia,1989,3(5):270-276.
[10] Lenormand P, Brondello JM, Brunet A, et al. Growth factor-induced p42/p44 MAPK nuclear translocation and retention requires both MAPK activation and neosynthesis of nuclear anchoring proteins[J]. J Cell Biol, 1998,142(3): 625-633.
[11] Porras A, Alvarez AM, Valaldares A, et al. p42/p44 mitogen-activated protein kinases activation is required for the insulin-like growth factor-Ⅰ/insulin induced proliferation, but inhibits differentiation, in rat fetal brown adipocytes[J]. Mol Endocrinol, 1998, 12(6): 825-834.
[12] Starr R, Novak U, Willson TA, et al .Distinct roles for leukemia inhibitory factor receptor α-chain and gp130 in cell type-specific signal transduction[J]. J Biol Chem , 1997, 272(32): 19982-19986.