bcl-xL基因介导白血病细胞多药耐药的形成
第四军医大学学报2000年第21卷第1期
白庆咸 黄高升 王哲 张晓晖
摘 要:目的 观察bcl-xL基因可否介导白血病细胞的多药耐药,并探讨其机制.方法 采用脂质体法将bcl-xL cDNA转导入HL-60细胞;免疫印迹法检测Bcl-xL及抗凋亡蛋白Bax的表达;MTT法测定足叶乙甙、柔红霉素、阿霉素对转染细胞的细胞毒性;流式细胞仪定量检测凋亡细胞及细胞内药物浓度.结果 Bcl-xL高表达可抑制足叶乙甙诱发的凋亡,抑制率为40.5%;降低上述化疗药物的细胞毒作用,耐药指数分别为3.2,3.2,1.6;但细胞内柔红霉素药物浓度无改变.结论 Bcl-xL可能作为一种新的耐药途径,通过抑制化疗药物诱发的细胞凋亡参与多药耐药的形成.
关键词:白血病;bcl-xL基因;凋亡;多药耐药
0 引言
bcl-x基因的长型mRNA (bcl-xL)编码的蛋白功能类似Bcl-2,可使细胞耐受 细胞生长因子撤除诱导的凋亡[1].研究发现,鼠白血病细胞在体外长期传代培养过程中自发形成的耐药亚株及化疗药物诱导产生的人白血病耐药细胞株均表达较高水平的Bcl-xL蛋白[2,3].为明确bcl-xL基因与白血病细胞耐药的相关性,我们采用脂质体法将bcl-xL基因转导入HL-60细胞中,观察该基因高表达对白血病细胞凋亡易感性及化疗药物敏感性的影响,并进一步探讨其作用机制.
1 材料和方法
1.1 材料 脂质体lipofectamine(Gibco),苯甲基磺酰氟(PMSF)、 噻唑蓝(MTT) [Sigma], 兔抗人Bcl-x, bax多克隆抗体(Santa Cruz), HRP连接的羊抗兔IgG (Jackson),足叶乙甙(Merck),柔红霉素、阿霉素(Phamarcia). 人全长bcl-xL cDNA (由美 国Thompson c.B.教授惠赠)正向插入逆转录病毒载体pDOR-neo,重组表达载体称为pDSBL. 详细构建过程参阅文献[4].
1.2 方法 细胞系及基因转染参照Gibco公司产品说明书. 2×106处于对数生长期的HL-60细胞(中国科学院上海细胞生物研究所提供,常规培养于含100 mg·L-1胎牛血清的RPMI1640液中)悬浮于0.8 mL无血清无抗生素的RPMI 1640液中. 3~5 μg质粒DNA(pDSBL或pDOR-neo)与10 μL脂质体分别溶于100 μL同样培养液中,然后将两液混合,室温放置15 min以形成脂质体-DNA复合物.将此混合物逐滴缓慢加入细胞悬液内,37℃、50 mL·L-1 cO2条件下孵育6 h,加入4 mL 含150 mL·L-1胎牛血清的RPMI1640液继续培养60 h. 离心收集细胞备用.
1.2.1 免疫印迹分析(Western blot) 2×106 转染细胞于0.2 mL裂解液(含 5 mL·L-1 NP-40及0.1 mmol·L-1 pMSF)中冰浴20 min,回收上清. 加入等 体积2×SDS上样缓冲液,煮沸10 min. 取该液20 μL经125 g·L-1聚丙烯酰胺凝胶电泳,电转移.载有蛋白的硝酸纤维膜经10 g·L-1 BSA封闭过夜,与Bcl-x抗体或Bax抗体室温孵育2 h,连接HRP的羊抗兔IgG孵育1 h, DAB显色.
1.2.2 细胞毒测定(MTT法) 参照文献[2]. 靶 细胞以2×104/孔,100μL体积接种于96孔板,37℃、50 mL·L-1 CO2孵箱内过夜.然后分别加入不同浓度的足叶乙甙(VP-16)、柔红霉素和阿霉素,孵育24 h. 每孔加入MTT 100 μg,继续孵育4 h,小心吸弃上清. 各孔加150μL二甲亚砜,振荡后测每孔隙A490 nm值,计算杀伤率.对数纸作图,求IC50值.
1.2.3 凋亡细胞的定量检测 参照前期试验的诱导凋亡条件 .5×105.mL-1的转染细胞与10 mg·L-1足叶乙甙孵育5 h, PBS洗涤后收集细胞计4×106. 预冷的700 mL· L-1乙醇固定1 h,碘化丙锭(PI)染液(含50 mg·L-1 PI, 1 mL·L-1 triton X -100, 100 mg·L-1 RNaseA)染色30 min,流式细胞仪(FCM)检测.资料经LysisII软件收集、贮存、分析.
1.2.4 细胞内药物浓度测定[5] 2×105.mL-1对数生长期的细胞,PBS洗涤, 1500 r·min-1离心10 min后,混悬于RPMI 1640液中,加入柔红霉素10 mg·L-1,37℃孵育1 h,预冷的PBS洗涤3次. 台盼蓝染色活细胞数需大于97%.其样品再经流式细胞仪检测.
统计学方法: t检验.
2 结果
2.1 转染细胞的Bcl-xL及Bax表达 Western印迹分析显示,pDSBL转染后的HL-60细胞(HL-60/bcl-xL) bcl-xL (相对 分子质量29×103)较空载体转染的对照细胞(HL-60/neo)明显增高,而两种细胞的Bax(相对分子质量21×103)表达则无明显差别.
2.2 转染bcl-xL的HL-60细胞对化疗药物的敏感性 MTT法显示,足叶乙甙、柔红霉素、阿霉素对HL-60/bcl-xL细胞的细胞毒作用有不同程度的降低, iC50增高. HL-60/bcl-xL细胞对上述三药的IC50值分别升至对照细胞的3.2,3.2及1.6倍(Tab 1).
表1 bcl-xL降低HL-60细胞对化疗药物的敏感性
tab 1 Decrease of sensitivity of HL-60/bcl-xL cells to chemotherapeutic d rugs
(n=3, X±s)
| Drugs |
ρ(IC50)/(μg·L-1) |
Resistance
factor |
| HL-60/bcl-xL |
HL-60/neo |
| Etoposide |
2004±230b |
634±73 |
3.2 |
| Daunorubicin |
228± 26b |
71± 8 |
3.2 |
| Adryamicin |
798± 92a |
503±58 |
1.6 |
resistance factor: x- fold increase of iC50 in comparison with HL-60/ne o cells as determined by MTT assays.
aP<0.05, bP<0.01 vs HL-60/neo.2.3 Bcl-xL高表达抑制足叶乙甙诱发的凋亡 转染bcl-xL的HL-60细胞(HL-60/bcl-xL)及对照细胞(HL-60/neo)经足叶 乙甙处理后,FCM定量分析显示HL-60/bcl-xL细胞的凋亡比例明显减少,由HL-60/neo细胞的39.3%降为23.3%,抑制率为40.5%,并且HL-60/bcl-xL细胞的G1期比例增高(Tab2).
表2 bcl-xL高表达抑制VP-16诱导HL-60细胞凋亡的FCM检测结果
tab 2 Inhibition of etoposide-induced apoptosis by the overexpression of bcl- xL
(x/1)
| Cells |
Before treatment |
After treatm ent |
| Apoptotic
rate/% |
G1 |
G2 |
S |
Apoptotic
rate/% |
G1 |
G2 |
S |
| HL-60/
neo |
0 |
0.36 |
0.12 |
0.52 |
39.3 |
0.69 |
0.11 |
0.20 |
| HL-60/
bcl-xL |
0 |
0.40 |
0.09 |
0.51 |
23.3 |
0.84 |
0.0 6 |
0.10 |
2.4 转染细胞中药物含量的改变 柔红霉素处理细胞后,通过流式细胞仪检测细胞内柔红霉素的红色荧光强度,以确定细胞内相对药物含量. fig 1未显示转染细胞及对照细胞内药物含量存在差异.
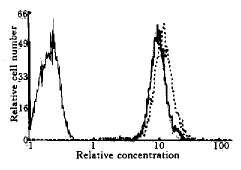
图1 转染细胞及对照细胞内柔红霉素相对含量
fig 1 Relative concentrations of daunorubicin in HL-60/bcl-xL and control cel ls
hL-60 negative control; HL-60/neo; --- HL-60/bcl-xL.
3 讨论
白血病细胞多药耐药的产生是化疗失败的主要原因.以往已有较多研究发现,经典耐药机制膜糖蛋白(p170,p180)具有外排泵功能,可以将进入细胞内的药物泵出细胞外,降低细胞内药物浓度[6].膜糖蛋白(p170,p180)在急性髓细胞白血病中高表达与化疗失败密切相关[7].我们的研究结果显示,Bcl-xL在HL-60细胞中高表达可降低足叶乙甙、柔红霉素、阿霉素的细胞毒作用,即转染细胞对以上药物的抗性增 加,但细胞内柔红霉素的浓度并无改变. 这说明Bcl-xL介导的耐药,其机制不同于膜糖蛋白. bcl-xL可能在药物作用的较下游,即通过调变药物作用的终环节靶细胞的凋亡而发挥作用. minn等[8]发现抗凋亡基因bcl-xL转染入体外依赖IL-3生长的鼠前淋巴细胞系FL5.12,可使该细胞耐受多种细胞毒药物引发的凋亡.我们在实验中, 将bcl-xL导入HL-60细胞, 高表达的Bcl-xL也可抑制足叶乙甙诱发的HL-60细胞凋亡.这表明bcl-xL很可能作为一种新的耐药机制,通过抑制凋亡介导白血病细胞的耐药形成.
Bcl-xL抑制细胞凋亡的分子机制尚存有争议. 由于Bcl-xL可与抗凋亡蛋白Bax形成异源二聚体[9],因此推测Bcl-xL拮抗凋亡的机制可能为过表达的Bcl-xL与Bax结合,从而降低游离及同源二聚体的Bax量,抑制Bax的促凋亡作用. ibrado等[10]发现转染Bcl-xL细胞的Bax总量并无降低,但转染细胞中与Bcl-xL形成异源二聚体的Bax量增多, 游离Bax明显减少.也有实验显示Bc l-xL的抗凋亡作用可不依赖于Bax, 即Bcl-xL与Bax形成异源二聚体并非Bcl-xL发挥保护细胞免受凋亡作用所必需[11].我们研究未显示转染细胞的Bax表达减少, 由于We stern免疫印迹法测得的胞质Bax为细胞内总Bax,所以尚难以评价Bax在Bcl-xL抑制凋亡中 的作用.
基金项目:国家自然科学基金资助项目(39400057)
作者简介:白庆咸(1962-),女(汉族),陕西省西安市人.讲师,主治医师,博士(导师黄高升). Tel.(029)3375209 Email. wjdqx@fmmu.edu.cn白庆咸(第四军医大学:西京医院血液科,陕西西安 710033)
黄高升(第四军医大学:基础部病理学教研室,陕西 西安710033)
王哲(第四军医大学:基础部病理学教研室,陕西 西安 710033)
张晓晖(第四军医大学:基础部病理学教研室,陕西 西安710033)
参考文献
[1]Boise LH, Gonzalez-Carcia m, Postema CE et al. bcl-x, a bcl-2-related gene that functions as a dominant reg lator of apoptotic cell death [J]. Cell,1 993;74:597-608.
[2]Kuhl JS, Krajewski S, Duran GE et al. Spontaneous overexpression of the long form of the Bcl-x protein in a highly resistant P388 leukemia [J]. Br J cancer,1997;75(2): 268-274.
[3]Han ZY, Chatterrjee D, Early J et al. Isolation and characteriza tion of an apoptosis-resistant variant of human leukemia HL-60 cells that has switched expression from Bcl-2 to Bcl-xL [J]. Cancer Res, 1996; 56(7): 1621-1628.
[4]白庆咸,黄高升,陈协群. 重组bcl-xL逆转录表达载体的构建及鉴定[J]. 第四军医大学学报,1997;18(5):封3.
[5]何一心,扬少光,张淑靖et al.多药耐药性细胞的鉴别和分离[J]. 中华血液学杂志,1992;13(4):173-175.
[6]Arceci RJ. Clinical significance of p-glycoprotein in multidrug resistance malignancies [J]. Blood, 1993; 81(9):2215-2222.
[7]Del Poeta G, Stasi R, Aronica G et al. Clinical relevance of p-glycoprotein expression in de novo acute myeloid leukimia [J]. Blood, 1996;87:1997-2004.
[8]Minn AJ, Rudin CM, Boise LH et al. Expression of Bcl-xL can confer a multidrug resistance phenotype [J]. Blood, 1995;86(5):1903-1910.
[9]Sato T, Hanada M, Bodrug S et al. Interactions among members of the Bcl-2 protein family analyzed with a yeast two-hybrid system [J]. Proc Natl Acad sci USA ,1994;91:9238-9242.
[10]Ibrado AM, Liu L, and Bhalla K. Bcl-xL overexpression inhibites progression of molecular events leading to paclitaxel-induced apoptosis of human acute myeloid leukemia HL-60 cells [J]. Cancer Res, 1997;57(6):1109-1115.
[11]Cheng EH.-Y, Levine B, Boise LH et al. Bax-independent inhibition of apoptosis by Bcl-xL [J]. Nature,1996;379:554-556.