具有阵发性睡眠性血红蛋白尿症表型的B淋巴细胞株的建立
中华血液学杂志2000年第21卷第3期
李克 邵宗鸿 川口辰哉 张友山 赵明峰 王立 郝玉书 中熊秀喜
摘 要 目的 建立阵发性睡眠性血红蛋白尿症(PNH)和正常人的B细胞株,用以研究PNH。方法 用EB病毒感染PNH患者和正常人的B淋巴细胞,感染后的B淋巴细胞用流式细胞仪分析其细胞表型,然后用免疫磁珠分选CD55-、CD59- B淋巴细胞,并用极限稀释法对分选后的细胞进行克隆,克隆后的细胞株用聚合酶链反应技术扩增免疫球蛋白重链可变区基因重排带,验证其克隆性。结果 建立了2株分别来自于2例PNH患者的CD55-、CD59-B细胞株;作为对照,同时建立了2株分别来自于2名正常人的B细胞株。结论 可用EB病毒感染B细胞来建立PNH患者的B细胞株。
关键词:血红蛋白尿,阵发性 细胞系 淋巴细胞 疱疹病毒4型,人
阵发性睡眠性血红蛋白尿症(PNH)是一种获得性造血干细胞克隆性疾病。临床主要表现为溶血、易感染、栓塞和骨髓造血功能低下。目前溶血的发生机制已基本明了,PNH红细胞膜上糖化肌醇磷脂(GPI)锚合成缺陷,导致膜上GPI锚定蛋白缺乏,其中包括衰变加速因子(DAF,CD55)和反应性溶血膜抑制物(MIRL,CD59)等,从而引起补体介导的溶血。位于X染色体上的PIG-A基因异常则是引起上述异常的根本原因[1]。已知,CD55、CD59不仅在PNH患者粒细胞和红细胞膜上缺乏,而且也在T和B淋巴细胞上缺乏,提示PNH是一干细胞疾病[2]。淋巴细胞有可能在PNH发病,特别是PNH克隆异常增生中起重要作用。然而,在研究其作用时,常常由于不能得到足够数量的淋巴细胞而影响研究的进行。为此,我们建立了两株PNH CD55-、CD59-的EB病毒转化的B淋巴细胞,作为对照,我们同时建立了两株正常人B淋巴细胞。
材料和方法
1 患者及其淋巴细胞的分离 分离了8例PNH患者和3名正常人的淋巴细胞用于B细胞株的建立。PNH的诊断依据临床表现、Ham试验阳性和CD55-、CD59-细胞检测的结果。淋巴细胞分离采用密度梯度离心法。
2 EB病毒的制备 产生EB病毒的细胞株B95-8由日本熊本大学Horikawa博士惠赠,在含体积分数为10%的小牛血清(FCS)和100mg/L氨苄青霉素的RPMI 1640(Gibco公司)培养基中培养5~7d后,1500r/min离心,上清液即含高滴度的EB病毒。
3 EB病毒的转化 参照文献[3],淋巴细胞与上述方法制备的EB病毒在1ml含体积分数为7%的FCS和2mg/L环孢菌素A(CsA)的RPMI 1640培养基中,在体积分数为5%的CO2及37℃条件下孵育2h,离心后弃上清,加入1ml含体积分数为20%的FCS和2mg/L CsA的RPMI 1640培养基,在体积分数为5%的CO2及37℃条件下孵育,每3d进行半量换液,培养1个月后将转化后的细胞转入24孔培养板继续培养,定期进行半量换液。如3个月后,细胞生长良好即可进行表型鉴定和克隆筛选。
4 极限稀释法克隆筛选 取8×104细胞,用含体积分数为20%的FCS的RPMI 1640培养液按对数级稀释5次,取100μl最终稀释液于96孔培养板,在体积分数为5%的CO2及37℃条件下培养,每3d进行半量换液。生长良好的克隆转入24孔板继续培养,并进行表型鉴定。
5 流式细胞术分析细胞表型 方法参照文献[4]。所采用的单克隆抗体为:CD2(T细胞标志,BD 公司),CD20(B细胞标志,BD公司),CD55和CD59(日本东京大学Towita博士惠赠)。分设对照管和试验管,每管加入105细胞,PBS洗涤2次,试验管加入上述抗体10μl,在4℃下孵育30min后再加入兔抗鼠FITC-IgG,4℃下孵育20min,对照管不加上述抗体,只加兔抗鼠FITC-IgG。PBS洗涤2次后,加入1ml PBS,混匀待测。采用流式细胞仪(FACScan, BD 公司)测定细胞表型。
6 克隆性鉴定 方法参照文献[5],DNA提取采用常规酚-氯仿法。引物序列:顺义链引物F3A:5′-ACACGGCTCTGTATTACTGT-3′,反义链引物LJH:5′-TGAGGAGACGGTGACC-3′。聚合酶链反应体积为50μl,反应体系含10μmol/L引物各2μl,模板DNA 1μg,Taq酶2U,1.5mmol/L MgCl2;反应条件为94℃ 2min,58℃ 45s,72℃ 105s,共30个循环。反应产物用25g/L琼脂糖凝胶电泳,溴化乙锭染色,紫外照相。阳性对照采用B-急性淋巴细胞白血病细胞系KHM2B。
结 果
8例PNH患者的外周血CD55-、CD59-淋巴细胞所占百分率为21.5%~90.5%。其中只有6例患者淋巴细胞经EB病毒感染后可获得不死性生长。流式细胞术分析显示6例中的4例患者不死性生长细胞几乎全部为CD55+、CD59+细胞,另2例患者不死性生长细胞中CD55-、CD59-淋巴细胞占32.6%和55.4%。后者经用免疫磁珠分选,90%以上的细胞表型为CD55-、CD59-。分选后的细胞用于细胞克隆。3名正常人B淋巴细胞经EB病毒感染后2名的细胞可获得不死性生长。
EB病毒转化后的细胞经反复冻存后复苏均能良好生长,观察时间已超过半年。细胞生长不依赖于生长因子。经流式细胞术分析法分析显示不死性生长细胞的表型为CD2-和CD20+,为B淋巴细胞。
采用极限稀释法对2例PNH患者和2名正常人经EB病毒转化后的B淋巴细胞进行了细胞克隆。分别选取6个克隆,用聚合酶链反应方法扩增其免疫球蛋白重链基因VDJ重排区,进行克隆性验证。结果显示,所有被检克隆均只有一条重排带(图1),提示为单克隆性造血。同时对其进行细胞表型分析,结果显示,来自于PNH患者的所有克隆表面标志为CD2-、CD20+、CD55-、CD59-;来自于正常人的所有克隆表面标志为CD2-、CD20+、CD55+、CD59+。分别选取一个生长较好的克隆持续培养,用作不死性细胞株。
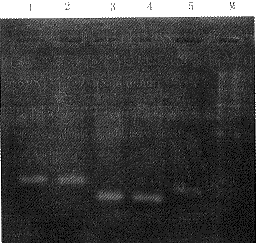
1,2:PNH细胞系;3,4:正常对照B细胞系;
5:阳性对照(B-ALL细胞系KHM2B);M为分子量标准
图1 细胞系克隆PCR产物电泳结果
讨 论
EB病毒由172kb的dsDNA组成,可表达近100种病毒蛋白,其中6种核蛋白具有启动和维持B淋巴细胞生长的功能,它们是EBNA-1,2,3a,3b,3c和LP。EB病毒通过结合B淋巴细胞表面上的EB病毒受体而感染B淋巴细胞,导致B淋巴细胞的不死性生长[6]。通常情况下,只有B淋巴细胞能受到感染,但少数情况下,T淋巴细胞也可被感染,因而对EB病毒感染后的细胞一定要进行淋巴细胞亚群鉴定。
我们对8例PNH患者淋巴细胞进行了与EB病毒的共培养,结果只能从2例PNH患者中获得不死性CD55-、CD59-B淋巴细胞株,其它6例患者因EB病毒感染后CD55-、CD59-淋巴细胞所占百分率太低而难以获得CD55-、CD59-B淋巴细胞株。获得不死性CD55-、CD59-B淋巴细胞株的2例患者在进行EB病毒转化前CD55-、CD59-淋巴细胞所占百分率分别为24.5%和56.4%,提示CD55-、CD59-淋巴细胞是否能感染EB病毒并获得不死性生长与其感染前所占百分率无明显关系。3名正常人中的2名可获得不死性生长B淋巴细胞,提示正常人B淋巴细胞较易被EB病毒感染。2名PNH患者的B淋巴细胞经EB病毒转化后CD55-、CD59-淋巴细胞与CD55+、CD59+淋巴细胞共存,在进行细胞克隆前,我们先用免疫磁珠法对CD55-、CD59-细胞进行分选1~2次,分选后几乎全部为CD55-、CD59-细胞。
利用分选后的细胞采用极限稀释法进行细胞克隆,实施起来确实有一定的难度,成功率只有1%~2%,因而需要培养较多的克隆才有机会获得单个细胞的生长;同时,使用含较高浓度FCS的培养基和操作仔细也是成功的关键。大多数的细胞克隆经用聚合酶链反应扩增免疫球蛋白基因的方法证实为单克隆性细胞。在用EB病毒感染淋巴细胞时,我们开始按传统方法[6]并未使用CsA来抑制T细胞的生长,但难以获得不死性生长B淋巴细胞,后来加用2mg/L CsA则较易获得不死性生长B淋巴细胞,说明CsA在建立B淋巴细胞株时起较重要的作用。我们相信用EB病毒感染PNH患者B淋巴细胞所建立的B淋巴细胞株,将是体外研究PNH的有用工具。
作者单位:李克(300020 天津,中国医学科学院、中国协和医科大学血液学研究所、血液病医院)
邵宗鸿(300020 天津,中国医学科学院、中国协和医科大学血液学研究所、血液病医院)
张友山(300020 天津,中国医学科学院、中国协和医科大学血液学研究所、血液病医院)
赵明峰(300020 天津,中国医学科学院、中国协和医科大学血液学研究所、血液病医院)
王立(300020 天津,中国医学科学院、中国协和医科大学血液学研究所、血液病医院)
郝玉书(300020 天津,中国医学科学院、中国协和医科大学血液学研究所、血液病医院)
川口辰哉(日本熊本大学医学院)
中熊秀喜(日本熊本大学医学院)
参考文献
1 Rosse WF, Ware RE. The molecular basis of paroxysmal nocturnal hemoglobinuria. Blood, 1995, 86:3277-3286.
2 Luzzatto L, Bessler M, Rotoli B, et al. Somatic mutations in paroxysmal nocturnal hemoglobinuria: a blessing disguise Cell, 1997, 88:1-4.
3 Hillmen P, Bessler M, Luzzatto L, et al. Production and characterization of lymphoblastoid cell lines with the paroxysmal nocturnal hemoglobinuria phenotype. Blood, 1993, 81:193-197.
4 Nakakuma H, Nagakura S, Horikawa K,et al. Interleukin-2 dependent T-cell lines established from paroxysmal nocturnal hemoglobinuria patients. Blood, 1994, 84:309-315.
5 Kevin JT, Michael JB, Colin JS, et al.Monoclonality in B-lymphoproliferative disorders detected at the DNA level. Blood,1990, 75: 2220-2222.
6 Wu TT, Swerdlow SH, Locker J, et al. Recurrent Epstein-Barr virus-associated lesions in organ transplant recipients. Hum Pathol ,1996, 27:157-164.